题目内容
 某补钙剂说明书的部分信息如图所示.小明对该补钙剂十分感兴趣,取10片钙片放入100g稀盐酸中,有效成分刚好完全反应(其他成分不与盐酸反应).剩余固体和液体总质量比反应前减少了2.2g.请完成下列问题:
某补钙剂说明书的部分信息如图所示.小明对该补钙剂十分感兴趣,取10片钙片放入100g稀盐酸中,有效成分刚好完全反应(其他成分不与盐酸反应).剩余固体和液体总质量比反应前减少了2.2g.请完成下列问题:(1)青少年缺钙会患
(2)反应生成了二氧化碳气体
(3)该钙片中含碳酸钙的质量分数是多少g?(写出计算过程)
考点:化学方程式的有关计算,药物的主要成分和疗效
专题:
分析:(1)青少年缺钙会患佝偻病和营养不良;
(2)减少的质量为二氧化碳;
(3)根据方程式2HCl+CaCO3=CaCl2+H2O+CO2↑计算10片中碳酸钙总质量,进而计算碳酸钙质量分数.
(2)减少的质量为二氧化碳;
(3)根据方程式2HCl+CaCO3=CaCl2+H2O+CO2↑计算10片中碳酸钙总质量,进而计算碳酸钙质量分数.
解答:
解:(1)青少年缺钙会患佝偻病和营养不良,故答案为:佝偻病;
(2)根据质量守恒,生成二氧化碳的质量为2.2 g,故答案为:2.2g;
(3)解:设10片钙片中CaCO3的质量x.
2HCl+CaCO3=CaCl2+H2O+CO2↑
100 44
x 2.2g
=
解得x=5g
10片钙片的质量是:10片×(100g÷100片)=10g,该钙片中含碳酸钙的质量分数是(5g÷10g)×100%﹦50%,
答:该钙片中含碳酸钙的质量分数是50%.
(2)根据质量守恒,生成二氧化碳的质量为2.2 g,故答案为:2.2g;
(3)解:设10片钙片中CaCO3的质量x.
2HCl+CaCO3=CaCl2+H2O+CO2↑
100 44
x 2.2g
| 100 |
| x |
| 44 |
| 2.2g |
解得x=5g
10片钙片的质量是:10片×(100g÷100片)=10g,该钙片中含碳酸钙的质量分数是(5g÷10g)×100%﹦50%,
答:该钙片中含碳酸钙的质量分数是50%.
点评:本题考查化学方程式有关计算,比较基础,有利于基础知识的巩固,体现化学社会性.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
下列气体能使品红溶液褪色的是( )
| A、O2 |
| B、NH3 |
| C、CO2 |
| D、SO2 |
用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工怍时的性能更优良,反应方程式为:Pb+PbO2+4HBF4
2Pb(BF4)2+2H2O,2Pb(BF4)2为可溶于水的强电解质,下列说法正确的是( )
| 放电 |
| 充电 |
| A、放电时的负极反应为:PbO2+4 H+十2e-=Pb2++2H2O |
| B、充电时,当阳极质量增加23.9 g时溶液中有0.2mo1电子通过 |
| C、放电时,正极区pH增大 |
| D、充电时,Pb电极与电源的正极相连 |
如图甲池和乙池中的四个电极都是惰性材料,请根据图示判断下列说法正确的是( )

| A、甲池中,b电极是负极 |
| B、a电极的电极反应式C2H5OH+16OH--12e-═2CO32-+11H2O |
| C、一段时间后,用湿润淀粉KI试纸靠近乙池d电极变蓝放电 |
| D、乙池在反应前后溶液的pH不变充电 |
下列化学用语表达正确的是( )
A、Cl-的结构示意图: | ||
| B、乙酸的结构式:C2H4O2 | ||
| C、氯化氢分子的电子式:H+[:Cl:]- | ||
D、质量数为137的钡原子:
|
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、1 mol Cu与足量稀HNO3反应,转移3nA个电子 |
| B、常温常压下,22.4LCl2含有2nA个Cl原子 |
| C、16gCH4含有10nA个电子 |
| D、1LO.1 mol.L-1Na2SO3溶液中含有O.1nA个S032- |
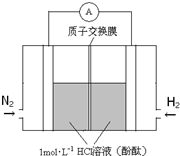 研究氮的固定具有重要意义.
研究氮的固定具有重要意义. A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大.A、D同主族;B、D、E三种元素原子的最外层电子数之和为9.又知B、D、E分别与A、C两元素形成的三种化合物X、Y、Z之间能相互发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M,1mol M中含有42mol电子.回答下列问题:
A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大.A、D同主族;B、D、E三种元素原子的最外层电子数之和为9.又知B、D、E分别与A、C两元素形成的三种化合物X、Y、Z之间能相互发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M,1mol M中含有42mol电子.回答下列问题: