题目内容
13.设NA为阿伏伽德罗常数,下列叙述正确的是( )| A. | 标准状况下,11.2L苯中含有分子数目为0.5NA | |
| B. | 常温下,1.8g水中含有的电子数为NA | |
| C. | 0.1 mol Cl2与足量氢氧化钠溶液反应,转移的电子数为0.2NA | |
| D. | 1L0.1mol/L的NH4CL溶液中含NH4+的数目为0.1NA |
分析 A.标准状况下苯的状态不是气体;
B.水分子中含有10个电子,1.8g水的物质的量为0.1mol,含有电子的物质的量为1mol;
C.0.1mol氯气与足量氢氧化钠溶液反应转移了0.1mol电子;
D.铵根离子部分水解,导致铵根离子的物质的量减小.
解答 解:A.标准状况下,苯不是气体,不能使用标准状况下的气体摩尔体积计算,故A错误;
B.1.8g水的物质的量为:$\frac{1.8g}{18g/mol}$=0.1mol,0.1mol水分子中含有1mol电子,含有电子的数目为NA,故B正确;
C.0.1 mol Cl2与足量氢氧化钠溶液反应生成0.1mol氯化钠和0.1mol次氯酸钠,转移了0.1mol电子,转移的电子数为0.1NA,故C错误;
D.1L0.1mol/L的NH4Cl溶液中含有氯化铵的物质的量为0.1mol,由于铵根离子部分水解,导致铵根离子的物质的量小于0.1mol,含NH4+的数目小于0.1NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,明确标准状况下气体摩尔体积的使用条件为解答关键,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题培养了学生的灵活应用能力.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
4.下列各项中表述错误的是( )
| A. | F的原子结构示意图: | |
| B. | CH3CH2COOH:从分类角度看该物质属于羧酸 | |
| C. | 次氯酸的电子式: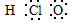 | |
| D. | 壬烷和癸烷,丁烷和新戊烷均为同系物 |
4.某同学拟用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,流程如图所示:
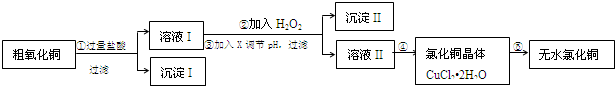
(1)步骤①中氧化铜与盐酸反应的离子方程式:CuO+2H+=Cu2++H2O.
(2)步骤②中加入H2O2的是为了将Fe2+氧化成Fe3+,Fe2+与H2O2在酸性溶液中反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)已知:
步骤③中调节pH的最佳范围为3.2-4.7,
步骤③中可以用于调节溶液pH的试剂X是bc:
a.NaOH b.CuO c. Cu(OH)2 d.NH3•H2O
(4)步骤⑤中要得到无水CuCl2,需要在干燥的HCl气流中加热CuCl2•2H2O,原因是在干燥的HCl气流中抑制Cu2+的水解,且带走CuCl2•xH2O受热产生的水气,故能得到无水氯化铜.

(1)步骤①中氧化铜与盐酸反应的离子方程式:CuO+2H+=Cu2++H2O.
(2)步骤②中加入H2O2的是为了将Fe2+氧化成Fe3+,Fe2+与H2O2在酸性溶液中反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7.0 | 9.0 |
步骤③中可以用于调节溶液pH的试剂X是bc:
a.NaOH b.CuO c. Cu(OH)2 d.NH3•H2O
(4)步骤⑤中要得到无水CuCl2,需要在干燥的HCl气流中加热CuCl2•2H2O,原因是在干燥的HCl气流中抑制Cu2+的水解,且带走CuCl2•xH2O受热产生的水气,故能得到无水氯化铜.
1.已知丁烷有两种同分异构体,则分子式为C4H9Cl的有机物共有(不考虑立体异构)( )
| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
8.下列电子式书写不正确的是( )
| A. |  | B. |  | C. |  | D. |  |
5.下列不属于混合物的是( )
| A. | 液氯 | B. | 漂白粉 | C. | 盐酸 | D. | 碘酒 |
2.下列情况可引起大气污染的是( )
①煤的燃烧
②工业尾气的任意排放
③燃放鞭炮
④汽车尾气.
①煤的燃烧
②工业尾气的任意排放
③燃放鞭炮
④汽车尾气.
| A. | 只有①② | B. | 只有② | C. | 只有②④ | D. | ①②③④ |
3.在25℃的纯水中通入一定量的氯化氢,当溶液的pH=1时,则由水电离出的c(H+)是( )
| A. | 1×10-1mol/L | B. | 1×10-6mol/L | C. | 1×10-3mol/L | D. | 1×10-13mol/L |