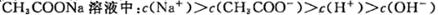题目内容
升高温度,0.01 mol·L-1下列溶液的pH基本不变的是
| A.NaOH | B.H2SO4 | C.NaCl | D.Na2CO3 |
B
解析试题分析:A、升高温度,OH?离子浓度不变,离子积Kw增大,所以H+浓度增大,pH减小;B、升高温度,H2SO4溶液H+浓度不变,则pH不变,正确;C、温度升高,NaCl溶液仍然为中性,因为离子积Kw增大,所以H+浓度增大,pH减小;D、温度升高,Na2CO3水解程度增大,pH改变。
考点:本题考查pH的分析与判断。

练习册系列答案
相关题目
为了同时对农作物施用含有N、P、K三种元素的化肥,对于给定的化肥:①KCl②K2CO3 ③Ca(H2PO4)2④NH4Cl⑤CO(NH2)2,不适合的组合是
| A.②③④ | B.①③④ | C.①③⑤ | D.①③④⑤ |
某温度下,向一定体积0.1 mol/L的氨水中逐滴滴加0.1mol/L的盐酸,溶液中pH与pOH[注:pOH=-lgc(OH-)]的变化关系如图所示,则下列说法中错误的是
| A.M点所示溶液中c( NH4+)>c(Cl-) |
| B.Q点所示溶液的导电熊力强于M点 |
| C.Q点消耗盐酸的体积等于氨水的体积 |
| D.M点和N点所示溶液中水的电离程度相同 |
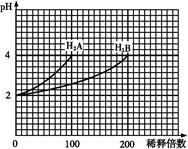
pH=2的两种一元酸X和Y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示.分别滴加0.1 mol/L NaOH至pH=7,消耗NaOH溶液的体积为Vx、Vy,下列说法正确的是
A.X为弱酸,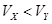 | B.Y为强酸,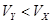 |
C.X为强酸, | D.Y为弱酸, |
下列溶液中微粒浓度关系一定正确的是
| A.将pH=5的H2SO4溶液稀释1×103后,c(H+):c(SO42-)=2:1 |
B.醋酸与醋酸钠的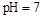 的混合溶液中:c(CH3COO-)+c(CH3COOH)<c(Na+) 的混合溶液中:c(CH3COO-)+c(CH3COOH)<c(Na+) |
C.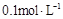 的硫酸铵溶液中:c(NH4+)+c(H+)>c(SO42-)+c(OH-) 的硫酸铵溶液中:c(NH4+)+c(H+)>c(SO42-)+c(OH-) |
| D.常温下pH=4的NaHC2O4溶液中:c(H2C2O4)<c(C2O42-) |
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图,下列判断正确的是( )
| A.a、c两点溶液的导电能力相同 |
| B.b点溶液中c(H+)+c(NH3·H2O)=c(OH-) |
| C.用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc |
| D.a、b、c三点溶液水的电离程度a>b>c |
常温下现有的四份溶液:
①0.01 mol/L HCl;②0.01 mol/L CH3COOH;
③pH=12 的氨水;④pH=12的NaOH溶液。
下列说法正确的是( )
| A.②中由水电离出的c(H+)=1×10-12 mol/L |
| B.将①、③混合,若有pH=7,则消耗溶液的体积:③>① |
| C.将②、④等体积混合(体积变化忽略不计),则c(CH3COO-)+c(CH3COOH)=0.01 mol/L |
| D.将四份溶液均稀释10倍后溶液pH:③>④,②<① |
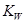 随着温度的升高而增大,说明水的电离是放热反应
随着温度的升高而增大,说明水的电离是放热反应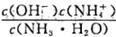 增大
增大