题目内容
常温下现有的四份溶液:
①0.01 mol/L HCl;②0.01 mol/L CH3COOH;
③pH=12 的氨水;④pH=12的NaOH溶液。
下列说法正确的是( )
| A.②中由水电离出的c(H+)=1×10-12 mol/L |
| B.将①、③混合,若有pH=7,则消耗溶液的体积:③>① |
| C.将②、④等体积混合(体积变化忽略不计),则c(CH3COO-)+c(CH3COOH)=0.01 mol/L |
| D.将四份溶液均稀释10倍后溶液pH:③>④,②<① |
D
解析

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
室温下,用0.100 0 mol·L-1NaOH溶液分别滴定体积均为20.00 mL的盐酸和醋酸溶液,滴定曲线如右图。下列说法正确的是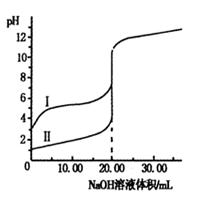
| A.I、Ⅱ分别表示盐酸和醋酸的滴定曲线 |
| B.盐酸和醋酸的浓度均为0.100 0 mol·L-1 |
| C.pH=7时,两种酸所消耗NaOH溶液的体积相等 |
| D.V(NaOH)=20.00mL时,c(Cl一)=c(CH3COO一) |
升高温度,0.01 mol·L-1下列溶液的pH基本不变的是
| A.NaOH | B.H2SO4 | C.NaCl | D.Na2CO3 |
常温时,下列叙述正确的是 ( )
| A.稀释pH=3的醋酸,溶液中所有离子的浓度均降低 |
B.一定浓度的CH3COOH和NaOH混合,溶液呈中性,则混合液中 |
| C.pH均为11的NaOH和Na2CO3溶液中,水的电离程度相同 |
| D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
水是一种极弱的电解质,在室温下,KW=1×10-14,则此时水的电离百分数为:
| A.1×10-7 | B.1/55.6 | C.10-14 | D.1/(55.6×107) |
用水稀释0.1 mol·L-1氨水时,溶液中随水量的增加而减小的是( )。
| A.c(OH-)/c(NH3·H2O) |
| B.c(NH3·H2O)/c(OH-) |
| C.n(OH-)和c(H+) |
| D.c(H+)和c(OH-)的乘积 |
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A.pH=4的醋酸中:c(H+)=4.0 mol·L-1 |
| B.饱和小苏打溶液中:c(Na+)=c(HCO3—) |
| C.饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1 |
25 ℃时,Kw =1.0×10-14;100 ℃时,Kw =5.5×10-13。下列说法正确的是( )
| A.100 ℃时,pH=12的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7 |
| B.25 ℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等体积混合,所得溶液的pH=7 |
| C.25 ℃时,0.2 mol/L NaOH溶液与0.2 mol/L CH3COOH恰好中和,所得溶液的pH="7" |
| D.25 ℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7 |