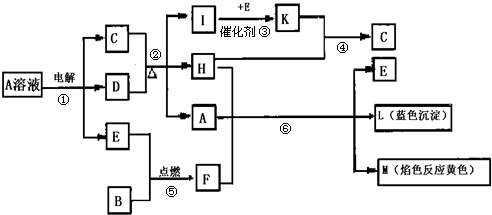
题目内容
16.对于可逆反应mA+nB═pC+qD从正反应开始反应并在一定条件下达到平衡后,如果增大压强,则容器内气体平均相对分子质量增大,下列有关判断错误的是( )| A. | 反应物A或B至少有一个是气体 | B. | 容器内不可能是单一气体 | ||
| C. | m+n可能大于p+q | D. | 若m<p,且D是气体,则B一定是气体 |
分析 对于可逆反应mA+nB═pC+qD,如果增大压强,平衡向气体体积减少的方向移动,如果反应物是非气体,虽平衡移动但相对分子质量不变;若反应物和生成物都是气体,增大压强平衡移动的结果,使得容器内气体的相对分子质量一定增大,由此分析解答.
解答 解:A、如果都是气体,压强改变,相对分子量不变,所以反应物A或B至少有一个是气体,故A正确;
B、如果器内是单一气体,相对分子量是一个定值,故B正确;
C、如反应物和生成物都是气体,平衡逆向移动,则容器内气体平均相对分子质量增大,所以m+n可能大于p+q,故C正确;
D、若m<p,且D是气体,与A和C的状态有关,B可能是气体也可能不是,故D错误;
故选D.
点评 本题考查外界条件对化学平衡的影响,学生要清楚平衡对外界影响导致平衡的移动,引起相对分子量的变化,然后得出气体的状态和计量数的大小,比较容易.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
6.Ⅰ.肼是一种高能燃料.已经各共价键键能(断裂或形成1mol共价键时吸收或释放的能量)如下:
则N2H4(g)+O2(g)?N2(g)+2H2O(l)△H=-583 KJ•mol-1
Ⅱ.密闭容器中进行反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H<02反应的化学平衡表达式为K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:600℃时,上述反应的平衡常数K=16.现有如图1甲(恒温恒压)和如图1乙(恒温恒容)两容器,起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡.

①关于甲、乙容器,下列说法正确的是AB
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4 ,两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=0.05mol/(L•min-1)
③平衡后若将乙容器体系温度突然降低100℃,如图2下述图象中能正确反映平衡移动过程中容器内变化情况的是B.
3为恒容绝热容器,进行上述反应,起始与平衡时的各物质的量见下表:
若在达到平衡后的容器丙中,分别按照下列A、B、C三种情况继续添加各物质,则再次达平衡时,容器丙中H2的百分含量按由大到小的顺序B>C>A(用A、B、C表示).
Ⅲ.25℃时,Fe(OH)3的ksp=4ⅹ10-38,现有盐酸酸化的0.08mol/L的FeCl3溶液,其PH=1,向其中加入等体积的0.05mol/L的NaOH溶液,可恰好开始析出沉淀(混合时溶液体积可直接加和).
| N≡N | O=O | N-N | N-H | O-H | |
| 键能(KJ•mol-1) | 946 | 497 | 154 | 391 | 463 |
Ⅱ.密闭容器中进行反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H<02反应的化学平衡表达式为K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:600℃时,上述反应的平衡常数K=16.现有如图1甲(恒温恒压)和如图1乙(恒温恒容)两容器,起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡.
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 2.0 | 1.0 | 2.0 | 0.5 |
| 乙/mol | 2.0 | 2.0 | 2.0 | 1.0 |

①关于甲、乙容器,下列说法正确的是AB
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4 ,两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=0.05mol/(L•min-1)
③平衡后若将乙容器体系温度突然降低100℃,如图2下述图象中能正确反映平衡移动过程中容器内变化情况的是B.
3为恒容绝热容器,进行上述反应,起始与平衡时的各物质的量见下表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 3.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 3.0 | 0 | 0 |
| B/mol | 0 | 0 | 3.0 | 3.0 |
| C/mol | m | n | p | q |
7.下表是元素周期表的一部分,请用化学用语回答:
(1)在这些元素中,最活泼的非金属元素是F,原子最外层达到稳定结构的元素是Ar;
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4;
(3)最高价氧化物具有两性的是Al2O3;
(4)④、⑤、⑥、⑧的离子半径由大到小为Cl->K+>Na+>Al3+;
(5)写出证明非金属性⑥比⑨强(用置换反应证明)的化学方程式2NaBr+Cl2=2NaCl+Br2;
(6)元素②、⑥与氢元素形成的一种常见化合物含有的化学键类型有离子键、共价键;其电子式为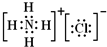 .
.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4;
(3)最高价氧化物具有两性的是Al2O3;
(4)④、⑤、⑥、⑧的离子半径由大到小为Cl->K+>Na+>Al3+;
(5)写出证明非金属性⑥比⑨强(用置换反应证明)的化学方程式2NaBr+Cl2=2NaCl+Br2;
(6)元素②、⑥与氢元素形成的一种常见化合物含有的化学键类型有离子键、共价键;其电子式为
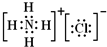 .
.
4.下列现象因发生物理变化引起的是( )
| A. | 活性炭使蓝色墨水褪色 | |
| B. | 盛石灰水的试剂瓶久置后内壁出现白色固体 | |
| C. | 蛋白质灼烧时发出烧焦羽毛的气味 | |
| D. | 湿润红布条置于氯气的集气瓶中,红布条褪色 |
11.碱性电池具有容量大、放电电流大的特点,得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+MnO2(s)+H2O(l)═ZnO (s)+Mn(OH)2 (s),下列说法错误的是( )
| A. | 电池工作时,锌失去电子 | |
| B. | 电池工作时,电子由正极通过外电路流向负极 | |
| C. | 电池正极的电极反应式为:MnO2(s)+2H2O(1)+2e-═Mn(OH)2 (s)+2OH-(aq) | |
| D. | 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
8.标准状况下,22.4LCO2的物质的量为( )
| A. | 0.20mol | B. | 0.50mol | C. | 1.0mol | D. | 2.0mol |
5. 现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )
现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )
 现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )
现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )| A. | 该有机物与溴水发生加成反应 | |
| B. | 该有机物与浓硫酸混合加热可发生消去反应 | |
| C. | 该有机物经催化氧化后能发生银镜反应 | |
| D. | 1mol该有机物与足量NaOH溶液反应最多消耗3molNaOH |