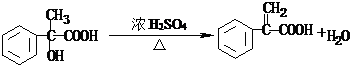
题目内容
11.下列离子方程式书写正确的是( )| A. | KMnO4溶液用盐酸酸化并加入H2O2:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O | |
| B. | Fe2(SO4)3和Ba(OH)2溶液混合:Fe3++SO42-+Ba2++3OH-=BaSO4↓+Fe(OH)3↓ | |
| C. | 等体积等物质的量浓度的AlCl3、Ba(OH)2、HCl溶液混合:3H++Al3++6OH-=Al(OH)3↓+3H2O | |
| D. | 水玻璃与稀醋酸混合:SiO32-+2H+=H2SiO3↓ |
分析 A.用盐酸酸化,可能氯离子被氧化;
B.不符合离子的配比;
C.等体积等物质的量浓度,则物质的量相等,反应生成水、氢氧化铝和氯化钡;
D.醋酸在离子反应中保留化学式.
解答 解:A.用盐酸酸化,可能氯离子被氧化,离子反应可能为2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O或2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,故A错误;
B.Fe2(SO4)3和Ba(OH)2溶液混合的离子反应为2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓,故B错误;
C.等体积等物质的量浓度,则含物质的量相等的AlCl3、Ba(OH)2、HCl溶液混合的离子反应为3H++Al3++6OH-=Al(OH)3↓+3H2O,故C正确;
D.水玻璃与稀醋酸混合的离子反应为SiO32-+2CH3COOH=H2SiO3↓+2CH3COO-,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
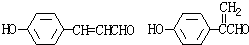
11. 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )| A. | 芥子醇的分子式是C11H14O4,属于芳香烃 | |
| B. | 芥子醇分子中所有碳原子不可能在同一平面上 | |
| C. | 芥子醇不能使酸性KMnO4溶液褪色 | |
| D. | 芥子醇可以发生氧化反应、取代反应、加成反应 |
2.下列措施对增大反应速率明显有效的是( )
| A. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| B. | Fe与稀硫酸反应制取H2时,改用浓硫酸 | |
| C. | Al在氧气中燃烧生成A12O3,将Al片改成Al粉 | |
| D. | Na与水反应时增大水的用量 |
19.四种短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数的2倍,Y、W同主族且能形成两种常见的化合物,X、W质子数之和是Z质子数的2倍.则下列说法中正确的是( )
| A. | 原子半径比较:X<Y<Z<W | |
| B. | X的氢化物沸点一定低于Y的氢化物 | |
| C. | Y的氢化物稳定性一定弱于W的氢化物 | |
| D. | 短周期所有元素中,Z的最高价氧化物的水化物碱性最强 |
6.下列叙述正确的是( )
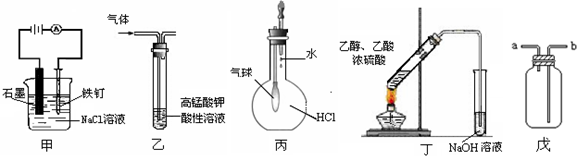
①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的乙炔
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体.

①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的乙炔
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体.
| A. | ①⑤ | B. | ②④ | C. | ③④ | D. | ③⑤ |
20.元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
| A. | 短周期元素形成离子后,最外层电子达到都达到8电子稳定结构 | |
| B. | 所有主族元素的正化合价数等于它的族序数 | |
| C. | 第3、4、5、6周期元素的数目分别是8、18、32、32 | |
| D. | 第4周期由左至右第8、9、10三列中没有非金属元素 |
1.已知:常温下,Ka(HF)>Ka(HClO).现有1L 0.1mol•L-1的两种溶液:①NaClO溶液;②NaF溶液.下列说法正确的是( )
| A. | c(H+):①>② | |
| B. | 分别加入1L 0.1mol•L-1HCl溶液后,两溶液的pH:①<② | |
| C. | 分别加入等浓度的盐酸至溶液呈中性,消耗盐酸的体积:①<② | |
| D. | n(HF)+n(F-)=n(HClO)+n(ClO-) |
 .
. .
. .
.