题目内容
4.有镁铝合金7.8g,加入某浓度的盐酸200ml,合金全部溶解,且在标准状况下收集到8.96L气体.在反应后的混合液中,当加入250ml4.0mol/LNaOH溶液时生成的沉淀质量最大.求:(1)合金中镁的质量;(2)盐酸的物质的量浓度.分析 (1)金属与生成氢气的关系式为Mg~H2、2Al~3H2,设出Mg、Al的物质的量,分别根据质量、生成氢气的量列式计算;
(2)沉淀达到最大时,此时溶质为NaCl,根据质量守恒可知:n(HCl)=n(NaCl)=n(NaOH),据此可计算出HCl的物质的量,然后根据c=$\frac{n}{V}$计算出盐酸的浓度.
解答 解:(1)设7.8g合金中含有Mg、Al的物质的量分别为x、y,
根据总质量可得:24x+27y=7.8,
根据生成氢气关系式Mg~H2、2Al~3H2可知:x+$\frac{3}{2}$y=$\frac{8.96L}{22.4L/mol}$=0.4mol,
联立解得:x=0.1mol、y=0.2mol,
则合金中Mg的质量为:24g/mol×0.1mol=2.4g,
答:合金中Mg的质量为2.4g;
(2)在反应后的混合液中,当加入250ml4.0mol/LNaOH溶液时生成的沉淀质量最大,此时溶质为NaCl,根据质量守恒可知:n(HCl)=n(NaCl)=n(NaOH)=4mol/L×0.25L=1mol,
所以该盐酸的物质的量浓度为:c(HCl)=$\frac{1mol}{0.2L}$=5mol/L,
答:盐酸的物质的量浓度为5mol/L.
点评 本题考查化学方程式的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握物质的量浓度的概念及表达式,能够利用关系式列式计算,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
14.用石墨作电极电解CuCl2和KCl的混合溶液,电解初期阴极和阳极分别析出的物质是( )
| A. | H2、Cl2 | B. | Cu、Cl2 | C. | H2、O2 | D. | Cu、O2 |
12.下列叙述不正确的是( )
| A. | H2S、H2O、HF 的稳定性依次增强 | |
| B. | RbOH、KOH、Ca(OH)2的碱性依次减弱 | |
| C. | Na、Mg、Al 的还原性依次增强 | |
| D. | H4SiO4、H2CO3、H2SO4的酸性依次增强 |
19.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| B. | 电解熔融MgCl2,可制得金属镁 | |
| C. | 在铁制品上镀银时,镀件为阳极,银盐为电镀液 | |
| D. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
9.用下列方法:①KMnO4受热分解;②KClO3受热分解(用MnO2作催化剂);
③2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ ④2Na2O2+2H2O═4NaOH+O2↑,若要制得相同质量的氧气,上述四种方法中所转移的电子数目之比是( )
③2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ ④2Na2O2+2H2O═4NaOH+O2↑,若要制得相同质量的氧气,上述四种方法中所转移的电子数目之比是( )
| A. | 3:2:1:4 | B. | 1:1:1:1 | C. | 1:2:1:2 | D. | 2:2:1:1 |
16.在2A+B?3C+4D反应中,表示该反应速率最快的是( )
| A. | υ(A)=0.5 mol/(L•s) | B. | υ(B)=0.3 mol/(L•s) | C. | υ(C)=12 mol/(L•min) | D. | υ(D)=6 mol/(L•min) |
13.下列溶液中滴加酚酞试液后出现红色且操作后可使颜色褪去的是( )
| A. | 明矾溶液加热 | B. | CH3COONa溶液加热 | ||
| C. | 氨水中加入少量NH4Cl | D. | Na2CO3溶液中加入BaCl2固体 |
14.只用一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )
| A. | NaOH | B. | H2S | C. | Ba(OH)2 | D. | AgNO3 |

 ;
; 和
和 ;
;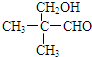 .
.