题目内容
5.实验室里用图所示装置制取并收集纯净的氯气.回答下列问题: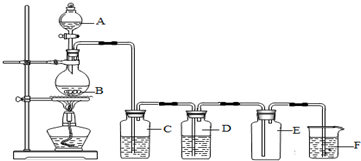
①写出烧瓶中发生反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
②C处盛有饱和食盐水,其作用是吸收HCl气体.
③D处盛放的试剂是浓硫酸(填名称),其作用是干燥气体.
④F处盛有氢氧化钠(填名称),发生反应的离子方程式为2OH-+Cl2=Cl-+ClO-+H2O.
分析 ①二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;
②浓盐酸具有挥发性,制取的氯气中混有杂质氯化氢,需要用饱和食盐水除去;
③除去氯化氢后的氯气中还混有水,需要用浓硫酸干燥;
④氯气有毒,需要用氢氧化钠溶液吸收.
解答 解:①二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
②制取的氯气中混有氯化氢气体,由于氯气在饱和食盐水中的溶解度较小,则可以用饱和食盐水除去氯气中的氯化氢杂质,
故答案为:吸收HCl气体;
③经过装置C后的氯气中混有水蒸气,需要用干燥剂除去,故D处盛放的是浓硫酸,用于干燥氯气,
故答案为:浓硫酸;干燥气体;
④氯气有毒,需要进行尾气吸收,氯气能够与氢氧化钠溶液反应,可用氢氧化钠溶液吸收氯气,反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O,
故答案为:氢氧化钠;2OH-+Cl2=Cl-+ClO-+H2O.
点评 本题考查了氯气的制法及化学性质,题目难度中等,明确氯气的制备原理及化学性质为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
15.下列离子方程式正确的是( )
| A. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 浓烧碱溶液中加入铝片:A1+2OH-═A1O2-+H2↑ | |
| C. | NO2与水的反应:3NO2+H2O═2NO3-+NO+2H+ | |
| D. | 用KIO3 氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
10.下列有关除杂质(括号中为杂质)的操作中,错误的是( )
| A. | 乙醇(水):加入足量生石灰充分振荡,蒸馏,收集馏出物 | |
| B. | 乙烷(乙烯):通过盛有足量酸性KMnO4溶液的洗气瓶洗气 | |
| C. | CCl4(乙醇):多次加水,振荡,分液,弃水层 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
17.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向醋酸钠水溶液中通入少量CO2:2CH3COO-+CO2+H2O═2CH3COOH+CO32- | |
| B. | 向FeBr2溶液中通过量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 | |
| C. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO${\;}_{4}^{-}$+6H++5H2O2═2Mn2++5O2↑+8H2O |
15.1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(一)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是MgO>CaO>NaCl>KCl,
Na、Mg、Al第一电离能I从小到大的排列顺序是Na、Al、Mg.
(二)(1)写出基态Cu原子的核外电子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1;位于元素周期表的ds区,金属铜采用下列C(填字母代号)堆积方式.

(2)氮及其化合物在生活、生产和科技等方面有重要的应用.请回答下列问题:
①在氮气分子中,氮原子之间存在着1个σ键和2个π键;
②用氢键表示式写出氮的氢化物溶液中存在的所有氢键O-H…N、N-H…O、O-H…O、N-H…N.
(一)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
Na、Mg、Al第一电离能I从小到大的排列顺序是Na、Al、Mg.
(二)(1)写出基态Cu原子的核外电子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1;位于元素周期表的ds区,金属铜采用下列C(填字母代号)堆积方式.

(2)氮及其化合物在生活、生产和科技等方面有重要的应用.请回答下列问题:
①在氮气分子中,氮原子之间存在着1个σ键和2个π键;
②用氢键表示式写出氮的氢化物溶液中存在的所有氢键O-H…N、N-H…O、O-H…O、N-H…N.
 、
、

 +H2O
+H2O ;
;



