题目内容
 (1)已知0.25molCH4完全燃烧生成液态水时放出222.5kJ 热量,则其热化学方程式是
(1)已知0.25molCH4完全燃烧生成液态水时放出222.5kJ 热量,则其热化学方程式是(2)燃料电池是将氢气、甲烷、乙醇等燃料在氧气中燃烧时的化学能直接转化为电能的装置.固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,其工作原理如图所示.电极b的电极反应式是:
(3)假设外电路是电解硫酸铜溶液的装置.若以C2H4为燃料气,工作一段时间后燃料电池中消耗了标准状况下的2.24L C2H4,则外电路阴极区的产物及其物质的量分别是
考点:热化学方程式,化学电源新型电池,电解原理
专题:化学反应中的能量变化,电化学专题
分析:(1)依据热化学方程式书写方法,标注物质聚集状态和反应焓变写出热化学方程式;
(2)燃料电池中,正极上是氧气得电子的还原反应,据此书写;
(3)在电解池的阴极是阳离子得电子的还原反应,根据电子守恒计算.
(2)燃料电池中,正极上是氧气得电子的还原反应,据此书写;
(3)在电解池的阴极是阳离子得电子的还原反应,根据电子守恒计算.
解答:
解:(1)0.25molCH4完全燃烧生成液态水时放出222.5kJ 热量,1mol甲烷燃烧生成二氧化碳和液态水放热890kJ,反应的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol;
(2)燃料电池中,通氧气的电极是正极,正极上是氧气得电子的还原反应,即O2+4e-=2O2-,故答案为:O2+4e-=2O2-;
(3)在电解池的阴极是铜离子得电子的还原反应,会析出金属铜,燃料电池中消耗了标准状况下的2.24L即0.1mol C2H4,根据电极反应:C2H4+6O2--12e-═2CO2+2H2O,转移电子是1.2mol,Cu2++2e-=Cu,所以此时生成铜的物质的量是0.6mol,故答案为:Cu;0.6mol.
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol;
(2)燃料电池中,通氧气的电极是正极,正极上是氧气得电子的还原反应,即O2+4e-=2O2-,故答案为:O2+4e-=2O2-;
(3)在电解池的阴极是铜离子得电子的还原反应,会析出金属铜,燃料电池中消耗了标准状况下的2.24L即0.1mol C2H4,根据电极反应:C2H4+6O2--12e-═2CO2+2H2O,转移电子是1.2mol,Cu2++2e-=Cu,所以此时生成铜的物质的量是0.6mol,故答案为:Cu;0.6mol.
点评:本题考查学生热化学方程式的书写、燃料电池的工作原理以及电子守恒的有关计算知识,难度中等.

练习册系列答案
相关题目
等浓度的下列稀溶液:①乙酸、②硫酸氢钠、③碳酸、④乙醇,它们的pH由小到大排列顺序正确的是( )
| A、④②③① | B、③①②④ |
| C、②①③④ | D、①②③④ |
可逆反应A(s)+3B(g)?2C(g)+D(g)在2L的密闭容器中反应,10min后,C的物质的量增加了0.6mol,则该反应的平均速率表示正确的是( )
| A、vA=0.03mol?L-1?min-1 |
| B、vB=0.045 mol?L-1?min-1 |
| C、vC=0.06mol?L-1?min-1 |
| D、vD=0.03 mol?L-1?min-1 |
在标准状况下,由两种气态烃组成的某混合气体2.24L完全燃烧后,得到3.36L二氧化碳和3.6g水,则两种气态烃可能是( )
| A、CH4和C3H8 |
| B、CH4和C3H4 |
| C、C2H6和C3H4 |
| D、C2H2和C2H4 |

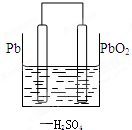 (1)铅蓄电池在生产生活中有广泛的应用,其工作原理为总方程式:Pb+PbO2+2H2SO4═2PbSO4+2H2O,其中负极为
(1)铅蓄电池在生产生活中有广泛的应用,其工作原理为总方程式:Pb+PbO2+2H2SO4═2PbSO4+2H2O,其中负极为