题目内容
反应CO2 (g)+2NH3(g)?CO(NH2)2(s)+H2O(g)△H<O,达到平衡时,下列说法正确的是( )
| A、加入催化剂,平衡常数不变 |
| B、减小容器体积,正、逆反应速率均减小 |
| C、增大CO(NH2)2的量,CO2的转化率减小 |
| D、降低温度,平衡向逆反应方向移动 |
考点:化学平衡建立的过程,化学平衡的影响因素
专题:
分析:A、催化剂改变化学反应速率,不改变化学平衡;
B、减小容器体积相当于增大压强,反应速率增大;
C、固体对化学平衡无影响;
D、反应是放热反应,降低温度,平衡正向进行;
B、减小容器体积相当于增大压强,反应速率增大;
C、固体对化学平衡无影响;
D、反应是放热反应,降低温度,平衡正向进行;
解答:
解:A、催化剂改变化学反应速率,不改变化学平衡,加入催化剂,平衡常数不变,故A正确;
B、减小容器体积相当于增大压强,反应速率增大,正逆反应速率都增大,故B错误;
C、固体对化学平衡无影响,增大CO(NH2)2的量,CO2的转化率不变,故C错误;
D、依据化学平衡移动原理分析,反应是放热反应,降低温度,平衡正向进行,故D错误;
故选A.
B、减小容器体积相当于增大压强,反应速率增大,正逆反应速率都增大,故B错误;
C、固体对化学平衡无影响,增大CO(NH2)2的量,CO2的转化率不变,故C错误;
D、依据化学平衡移动原理分析,反应是放热反应,降低温度,平衡正向进行,故D错误;
故选A.
点评:本题考查了化学平衡影响因素分析判断,平衡移动原理的理解应用,注意反应特征的方向,掌握基础是关键,题目较简单.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
等体积、等pH的盐酸和醋酸,与NaOH中和时,消耗NaOH的量( )
| A、相同 | B、盐酸多 |
| C、醋酸多 | D、无法比较 |
已知2X+O2→2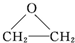 是原子利用率为100%的转化.下列对X的推断中不正确的是( )
是原子利用率为100%的转化.下列对X的推断中不正确的是( )
 是原子利用率为100%的转化.下列对X的推断中不正确的是( )
是原子利用率为100%的转化.下列对X的推断中不正确的是( )| A、可使酸性KMnO4溶液褪色 |
| B、可使溴水褪色 |
| C、一定条件下,可用H2除去乙烷中的X |
| D、与丙烯互为同系物 |
下列有关说法不正确的是 ( )
| A、反应NH3(g)+HCl(g)=NH4Cl(s)低温下能自发进行,说明该反应的△H<0 |
| B、常温下,将醋酸稀溶液加水稀释,溶液中c(H+)/c(CH3COOH)增大 |
| C、铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| D、Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
将4.34gNa、Na2O、Na2O2的混合物与足量水反应,生成的气体在标准状况下得到0.672L混合气体.该混合气体通过电火花产生器,恰好完全反应,则混合物中Na、Na2O和Na2O2的物质的量之比为( )
| A、1:1:1 |
| B、1:1:2 |
| C、1:2:1 |
| D、4:3:2 |
如图是制取CoCl2?6H2O的一种工艺流程图,若在实验室进行操作Ⅰ,则操作Ⅰ需要用到的仪器是( )

| A、容量瓶、玻璃棒、烧杯 |
| B、蒸发皿、玻璃棒、酒精灯 |
| C、量筒、玻璃棒、烧杯 |
| D、分液漏斗、蒸馏烧瓶、酒精灯 |
