题目内容
(1)30%的H2SO4和50%的H2SO4等质量混合后,所得溶液的质量分数 (填“大于”、“小于”或“等于”)40%,如果等体积混合,混合后溶液的质量分数 (填“大于”、“小于”或“等于”)40%.
(2)已知98%的浓H2SO4的物质的量浓度为18.4mol?L-1,试判断49%的H2SO4的物质的量浓度 (填“大于”、“小于”或“等于”)9.2mol?L-1.
(3)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是 .
(4)在标准状况下,CO和CO2的混合气体质量为36g,体积为22.4L,则CO所占的体积是 L,质量是 g.
(2)已知98%的浓H2SO4的物质的量浓度为18.4mol?L-1,试判断49%的H2SO4的物质的量浓度
(3)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是
(4)在标准状况下,CO和CO2的混合气体质量为36g,体积为22.4L,则CO所占的体积是
考点:溶液中溶质的质量分数及相关计算,物质的量的相关计算,物质的量浓度的相关计算
专题:
分析:(1)假设溶液质量均为100g,根据m(溶质)=m(溶液)×w(溶质)计算溶液中硫酸的质量,进而计算混合后溶液质量分数;
设50%H2SO4溶液密度为D,体积为V;30%H2SO4溶液密度为d,体积为V,计算溶质的总质量及混合后溶液总质量,表示出混合后的质量分数,结合硫酸浓度越大密度越大分析判断;
(2)设98%的浓H2SO4的密度为A,49%的H2SO4的密度为a,硫酸浓度越大,密度越大,则A>a,根据c=
表示出物质的量浓度,据此判断;
(3)同温同压下,气体体积之比等于其化学计量数之比,据此书写化学方程式,再根据原子守恒确定Z的化学式;
(4)根据n=
计算混合气体总物质的量,根据二者总质量、总物质的量列方程计算CO和CO2的物质的量,根据V=nVm计算CO的体积,根据m=nM计算CO的质量.
设50%H2SO4溶液密度为D,体积为V;30%H2SO4溶液密度为d,体积为V,计算溶质的总质量及混合后溶液总质量,表示出混合后的质量分数,结合硫酸浓度越大密度越大分析判断;
(2)设98%的浓H2SO4的密度为A,49%的H2SO4的密度为a,硫酸浓度越大,密度越大,则A>a,根据c=
| 1000ρω |
| M |
(3)同温同压下,气体体积之比等于其化学计量数之比,据此书写化学方程式,再根据原子守恒确定Z的化学式;
(4)根据n=
| V |
| Vm |
解答:
解:(1)假设溶液质量均为100g,30%的H2SO4溶液中硫酸质量为30g,50%的H2SO4溶液中硫酸质量50g,故混合溶液质量分数为
×100%=40%;
设50%H2SO4溶液密度为D,体积为V;30%H2SO4溶液密度为d,体积为V.则:混合后溶液总质量W=V(D+d),50%H2SO4溶液中H2SO4的质量=50%VD,30%H2SO4溶液中H2SO4的质量=30%Vd,混合后溶质总质量w=50%VD+30%Vd=V(50%D+30%d) 所得溶液质量分数=
=50%-20%
,由于D>d,
<
,故
>40%,
故答案为:等于;大于;
(2)设98%的浓H2SO4的密度为A,49%的H2SO4的密度为a,根据c=
可知,18.4=
,49%的H2SO4的物质的量浓度为
mol/L,硫酸浓度越大,密度越大,则A>a,故
mol/L<9.2mol/L,故答案为:小于;
(3)同温同压下,气体体积之比等于其化学计量数之比,则反应方程式表示为:X2(g)+3Y2(g)=2Z(g),根据原子守恒可知Z的化学式表示为XY3,故答案为:XY3;
(4)混合气体总物质的量为
=1mol,
设CO和CO2的物质的量分别为xmol、ymol,
根据二者总质量、总物质的量,则:
解得x=0.5 y=0.5
故CO的体积为0.5mol×22.4L/mol=11.2L
CO的质量为0.5mol×28g/mol=14g
故答案为:11.2;14.
| 30g+50g |
| 100g+100g |
设50%H2SO4溶液密度为D,体积为V;30%H2SO4溶液密度为d,体积为V.则:混合后溶液总质量W=V(D+d),50%H2SO4溶液中H2SO4的质量=50%VD,30%H2SO4溶液中H2SO4的质量=30%Vd,混合后溶质总质量w=50%VD+30%Vd=V(50%D+30%d) 所得溶液质量分数=
| 50%D+30%d |
| D+d |
| d |
| D+d |
| d |
| D+d |
| 1 |
| 2 |
| 50%D+30%d |
| D+d |
故答案为:等于;大于;
(2)设98%的浓H2SO4的密度为A,49%的H2SO4的密度为a,根据c=
| 1000ρω |
| M |
| 1000A×98% |
| 98 |
| 1000a×49% |
| 98 |
| 1000a×49% |
| 98 |
(3)同温同压下,气体体积之比等于其化学计量数之比,则反应方程式表示为:X2(g)+3Y2(g)=2Z(g),根据原子守恒可知Z的化学式表示为XY3,故答案为:XY3;
(4)混合气体总物质的量为
| 22.4L |
| 22.4L/mol |
设CO和CO2的物质的量分别为xmol、ymol,
根据二者总质量、总物质的量,则:
|
解得x=0.5 y=0.5
故CO的体积为0.5mol×22.4L/mol=11.2L
CO的质量为0.5mol×28g/mol=14g
故答案为:11.2;14.
点评:本题考查溶液浓度计算、化学方程式计算、物质的量有关计算,侧重考查学生分析计算能力,注意对公式的理解与应用,注意硫酸的浓度越大密度越大.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
下列化学用语正确的是( )
A、中子数为20的氯原子:
| ||||
| B、硫酸的电离方程式:H2SO4=H22++SO42- | ||||
| C、漂白粉的有效成分:CaCl2 | ||||
D、铝离子结构示意图: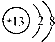 |
已知N元素最低化合价是-3价,最高化合价是+5价,那么下列物质中的N元素只具有氧化性的是( )
| A、NH3 |
| B、N2 |
| C、NO2 |
| D、HNO3 |
已知:6g碳不完全燃烧所得产物中,CO与CO2体积比为2:3,且C(s)+
O2(g)=CO(g)△H=-110kJ/mol;CO(g)+
O2(g)=CO2(g)△H=-283kJ/mol 与6g碳完全燃烧相比,损失的热量为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、283kJ |
| B、110kJ |
| C、196.5kJ |
| D、56.6kJ |