题目内容
6.某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如图:
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还一定含有的离子是Al3+、NH4+、Fe2+、SO42-,不能确定的阳离子是Fe3+.
(2)沉淀G的化学式为Fe(OH)3.
(3)写出生成沉淀I的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(4)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,且不能确定含有的离子只有一种.当X溶液中不能确定离子是Fe3+或Cl-,沉淀C物质的量>0.07mol(<0.07mol).
分析 在强酸性溶液中一定不会存在CO32-、SO32-离子;加入过量硝酸钡生成沉淀,则该沉淀为BaSO4,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,则一定为Fe2+离子;溶液B中加入过量NaOH溶液,沉淀G只为Fe(OH)3,生成气体F,则F为NH3,说明溶液中含有NH4+离子;溶液H中通入CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此进行解答.
解答 解:在强酸性溶液中一定不会存在CO32-、SO32-离子;加入过量硝酸钡生成沉淀,则该沉淀为BaSO4,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,则一定为Fe2+离子;溶液B中加入过量NaOH溶液,沉淀G只为Fe(OH)3,生成气体F,则F为NH3,说明溶液中含有NH4+离子;溶液H中通入CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,
(1)由以上分析可知上述离子中,溶液X中除H+外还一定含有的离子是Al3+、NH4+、Fe2+、SO42-,不能确定的阳离子为Fe3+,
故答案为:Al3+、NH4+、Fe2+、SO42-;Fe3+;
(2)Fe2+离子被氧化为Fe3+离子,加入NaOH溶液后生成Fe(OH)3,故答案为:Fe(OH)3;
(3)H中NaAlO2,沉淀I为氢氧化铝,偏铝酸根离子与二氧化碳反应生成氢氧化铝沉淀,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知亚铁离子为0.03mol,根据溶液电中性可知:2n(Fe2+)+3n(Al3+)+n(NH4+)=2n(SO42-),n(SO42-)=$\frac{2×0.03mol+3×0.01mol+0.01mol+0.04mol}{2}$=0.07mol,
当X溶液中不能确定的离子是Fe3+,则硫酸根离子的物质的量大于0.07mol,生成沉淀C硫酸钡的物质的量大于0.07mol;
当X溶液中不能确定的离子为Cl-,则硫酸根离子的物质的量小于0.07mol,生成沉淀C硫酸钡的物质的量小于0.07mol,
故答案为:Fe3+或Cl-;>0.07mol (<0.07mol ).
点评 本题考查了常见阴阳离子的检验、无机推断,题目难度中等,注意掌握常见离子的性质及检验方法,(3)为难点、易错点,注意溶液电中性知识在化学计算中的应用方法,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

 53随堂测系列答案
53随堂测系列答案| A. | 乙烷和乙烯 | B. | 乙醇与乙醛 | ||
| C. | 乙酸与甲酸甲酯(HCOOCH3) | D. | 淀粉和纤维素 |
| A. | 原子核外各电子层上的电子数均已达到2n2 | |
| B. | 所有电子在同一区域里运动 | |
| C. | 能量高的电子在离核近的区域运动 | |
| D. | 能量低的电子在离核近的区域绕核运动 |
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低化合价 | -2 | -3 | -1 | -3 |
| A. | ③和⑥、④和⑦分别处于同一主族 | |
| B. | 元素④处于第三周期ⅤA族 | |
| C. | 元素①与元素⑥形成的化合物中不可能存在共价键 | |
| D. | 元素⑧对应的氢氧化物可能具有两性 |
| 元素 | 元素性质或原子结构信息 |
| A | A元素的一种核素无中子 |
| B | B原子的次外层电子数等于最外层电子数的一半 |
| W | W的单质常温下为双原子分子,其氢化物的水溶液呈碱性 |
| G | G原子M层上有6个电子 |
| E | E元素的最高正价是+7 |
(2)B元素的最高价氧化物对应的水化物属于共价化合物(填‘离子化合物’或‘共价化合物’);
(3)W元素的最高价氧化物对应水化物能与其氢化物发生化合反应,反应方程式为HNO3+NH3=NH4NO3.
(4)元素G与元素E相比,非金属性较强的是氯(填元素名称),下列表述能证明这一事实的是b(填序号).
a.常温下E单质和G单质的密度不同;
b.E的氢化物比G的氢化物稳定;
c.E的氢化物水溶液酸性比G的氢化物水溶液酸性强
d.一定条件下G和E的单质都能与氢氧化钠溶液反应.
| A. | M元素一定是第VA族元素 | |
| B. | M元素一定是第三周期元素 | |
| C. | M可形成与CH3CHO电子数相等的化合物 | |
| D. | M的单质在空气中加热时可能会生成红棕色气体 |
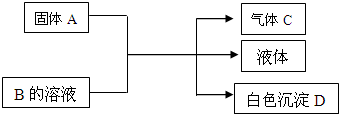 A、B、C、D均为中学化学常见的物质,它们间的反应关系如图所示.
A、B、C、D均为中学化学常见的物质,它们间的反应关系如图所示.