题目内容
13. 元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.
元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.(1)与氯元素同族的短周期元素位置为第二周期ⅦA.
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是bc(填序号).
a.Cl2、Br2、I2的熔点
b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液$→_{Ⅰ}^{80℃,通电}$ NaClO3溶液$→_{Ⅱ}^{室温,KCI}$KClO3晶体
①已知:I中有可燃气体生成,完成反应的化学方程式NaCl+3H2O$\frac{\underline{\;电解\;}}{\;}$NaClO3+3H2↑
②II中转化的基本反应类型是置换反应,该反应过程能析出KClO3晶体而无其它晶体析出的原因是室温下,氯酸钾在水中的溶解度明显小于其他晶体.
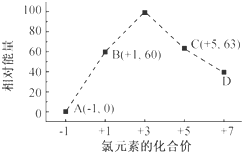
(4)一定条件,在水溶液中1mol Cl-、ClOx-(x=1,2,3,4)的能量(KJ)相对大小如图所示.
①D是ClO4-(填离子符号).
②B→A+C反应的热化学方程式为3 ClO-(aq)═ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol(用离子符号表示).
分析 (1)与氯元素同族的短周期元素为F元素;
(2)非金属性单质氧化性越强,元素非金属性越强,氢化物稳定性、最高价含氧酸的酸性、单质与氢气反应难易程度、元素化合时化合价等可以判断元素非金属性强弱,熔点属于物理性质,不能比较元素非金属性强弱,氢化物酸性也不能比较非金属性强弱;
(3)①电解氯化钠溶液生成NaClO3,同时有可燃气体生成,该气体为氢气;
②利用溶解度不同得到氯酸钾,反应中物质相互交换成分,属于复分解反应;
(4)①D微粒中Cl元素化合价为+7,结合离子所带电荷等于各元素化合价之和计算;
②B→A+C发生反应:3 ClO-=ClO3-+2Cl-,反应热△H=生成物总能量-反应物总能量,注意离子为溶液状态,进而书写热化学方程式.
解答 解:(1)与氯元素同族的短周期元素为F元素,处于周期表中:第二周期ⅦA,故答案为:第二周期ⅦA;
(2)a.单质的熔点属于物理性质,不能比较非金属性强弱,故a错误;
b. Cl2、Br2、I2的氧化性越强,元素的非金属性越强,故b正确;
c.氢化物越稳定,元素的非金属性越强,故c正确;
d. 氢化物的酸性不能比较非金属性强弱,如HF属于弱酸、HCl属于强酸,为F元素非金属性强于Cl的,故d错误,
故选:bc;
(3)①电解氯化钠溶液生成NaClO3,同时有可燃气体生成,该气体为氢气,反应方程式为:NaCl+3H2O$\frac{\underline{\;电解\;}}{\;}$NaClO3+3H2↑,
故答案为:NaCl+3H2O$\frac{\underline{\;电解\;}}{\;}$NaClO3+3H2↑;
②反应中物质相互交换成分,属于复分解反应;室温下,氯酸钾在水中的溶解度明显小于其他晶体,可以析出氯酸钾晶体,
故答案为:置换反应;室温下,氯酸钾在水中的溶解度明显小于其他晶体;
(4)①D微粒中Cl元素化合价为+7,则+7-x×(-2)=-1,解得x=4,故D为 ClO4-,故答案为:ClO4-;
②B→A+C发生反应:3 ClO-=ClO3-+2Cl-,根据离子能量可知,反应热△H=53kJ/mol+2×0kJ/mol-3×60kJ/mol=-117kJ/mol,故反应热化学方程式为:3 ClO-(aq)═ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol,
故答案为:3 ClO-(aq)═ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol.
点评 本题属于拼合型题目,涉及元素周期表与元素周期律、电解原理、基本反应原理、热化学方程式书写等,是对学生综合能力的考查,难度不大.

| A. | 有H、D、T与16O、17O、18O构成的过氧化氢分子的相对分子质量有36个 | |
| B. | H2、D2、T2互为同素异形体 | |
| C. | H2、D2、T2在相同条件下的密度比为1:2:3 | |
| D. | 氕、氘发生核聚变成其他元素,属于化学变化 |
| A. | K+.Al3+.Cl-.NO3- | B. | K+.Fe3+.Cl-.SiO32- | ||
| C. | H+.Fe2+.SO42-.Br2 | D. | K+.Ag+.NH3•H2O.NO3- |
| A. | 只有第2列元素的原子最外层有2个电子 | |
| B. | 第3列元素种类最多 | |
| C. | 第15列元素的最高价氧化物为R2O5 | |
| D. | 第17列元素的第一种元素无含氧酸 |
| A. | m=1,n=5 | B. | m=3,n=4 | C. | m=5,n=1 | D. | m=3,n=3 |
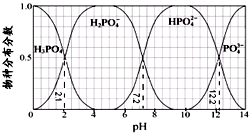
| A. | H3PO4的Ka3=10-12.2,HPO42-的水解平衡常数为10-6.8 | |
| B. | Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性 | |
| C. | 为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 | |
| D. | pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42-)>c(PO43-)>c(OH-)>c(H+) |
 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:
 .
. .
. .
.