题目内容
1.下列叙述正确的是( )| A. | 1.00molNaCl中含有6.02×1023个NaCl分子 | |
| B. | 1.00molNaCl中,所有的Na+的最外层电子总数8×6.02×1023 | |
| C. | 欲配制1L1.00mol/L的NaCl溶液,可将58.5gNaCl溶于1.00L水中 | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
分析 A.氯化钠为离子晶体,不存在分子;
B.1个Na+的最外层电子8;
C.水的体积不等于溶液的体积;
D.标准状况下,CCl4为液体.
解答 解:A.氯化钠为离子晶体,由离子构成,不存在NaCl分子,故A错误;
B.1个Na+的最外层电子8,则1.00molNaCl中,所有的Na+的最外层电子总数8×6.02×1023,故B正确;
C.将58.5gNaCl溶于1.00L水中,溶液体积大于1L,故C错误;
D.标准状况下,CCl4为液体,故D错误.
故选B.
点评 本题综合考查物质的量的相关计算和概念的理解,为高频考点,侧重于学生的分析、计算能力的考查,易错点为A、D,注意把握物质的构成特点以及气体摩尔体积的使用范围,难度不大.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
6.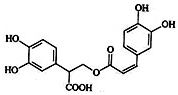 迷迭香酸是从蜂花属植物中提取得到的酸性物质.其结构如图.
迷迭香酸是从蜂花属植物中提取得到的酸性物质.其结构如图.
下列叙述正确的是( )
 迷迭香酸是从蜂花属植物中提取得到的酸性物质.其结构如图.
迷迭香酸是从蜂花属植物中提取得到的酸性物质.其结构如图. 下列叙述正确的是( )
| A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸最多能和9mol氢气发生加成反应 | |
| C. | 迷迭香酸可以发生加成反应、取代反应和酯化反应 | |
| D. | 迷迭香酸的化学式为C18H18O8 |
12.如图为某电池工作示意图,下列说法正确的是( )


| A. | 工作时,电解质溶液中K+向负极移动 | |
| B. | 电路若有0.4mol电子通过,则消耗O2的量为0.2mol | |
| C. | 一段时间后溶液中OH-浓度将升高 | |
| D. | 正极反应式为:O2+4e-+2H2O═4OH- |
16.下列热化学方程式中△H代表燃烧热的是( )
| A. | CH4 ( g )+$\frac{3}{2}$O2( g )═2H2O ( l )+CO ( g )△H1 | |
| B. | S ( s )+$\frac{3}{2}$O2 ( g )═SO3 ( s )△H2 | |
| C. | C6H12O6 ( s )+6O2 ( g )═6CO2 (g)+6H2O ( l )△H3 | |
| D. | 2CO ( g )+O2( g )═2CO2 ( g )△H4 |
13.自水常用氯气进行消毒.如果在实验室用自水配制下列物质的溶液,不会产生明显药品变质问题的是( )
| A. | AgNO3 | B. | NaI | C. | NaOH | D. | AlCl3 |
10.下列化学用语正确的是( )
| A. | 纯碱的化学式:NaHCO3 | B. | Cl原子的结构示意图: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 质量数为37的氯原子:${\;}_{17}^{37}$Cl |
11.下面有关晶体的叙述中,正确的是( )
| A. | 在氯化钠晶体中每个Na+(或Cl-)周围都紧邻8个Cl-(Na+) | |
| B. | 原子晶体中只存在共价键 | |
| C. | 离子晶体和分子晶体在熔化时,化学键都被破坏 | |
| D. | 熔融状态下能导电的晶体一定是金属晶体 |

 超导材料是材料研究的热点之一.我国化学家赵忠贤1987年发现了温度为110K的超导材料-铊钡钙铜氧系合金.请回答下列问题:
超导材料是材料研究的热点之一.我国化学家赵忠贤1987年发现了温度为110K的超导材料-铊钡钙铜氧系合金.请回答下列问题: