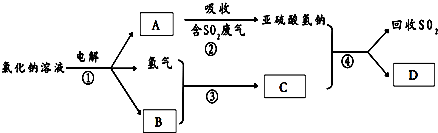
题目内容
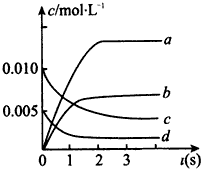 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表所示
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表所示
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是
(3)下列能说明该反应已达到平衡状态的是
A.v(NO2)=2u(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内密度保持不变
(4)某同学查阅资料得知,该反应K(300℃)>K(350℃);25℃时,生成1mol NO2,热量变化为56.4kJ.根据题目信息,该反应的热化学方程式为
(5)为使该反应的反应速度增大,且平衡向正反方向移动的是
A.及时分离除NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂
(6)用NH3催化还原NOx可以消除氮氧化物的污染.写出氨气消除NO污染的化学方程式
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)化学平衡常数,是指在一定温度下,可逆反应都达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
(2)由表中数据可知,平衡时c(NO)=
=0.0035mol/L,由方程式2NO(g)+O2(g)?2NO2(g)可知,平衡时△c(NO):△c(O2):△c(NO2)=2:1:2,据此判断表示NO2的浓度变化的曲线;由图中数据可知2s内,NO的浓度变化量为0.01mol/L-0.004mol/L=0.006mol/L,根据v=
计算v(NO),再根据速率之比等于化学计量数之比计算v(O2);
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)25℃时,生成1mol NO2,热量变化为56.4kJ,则生成2mol NO2,热量变化为112.8kJ,据此写出热化学方程式;
(5)根据化学反应速率的影响因素和化学平衡移动影响因素判断;
(6)根据反应物和生成物写出化学方程式;判断出氧化产物和还原产物,计算得到答案.
(2)由表中数据可知,平衡时c(NO)=
| 0.007mol |
| 2 |
| △c |
| △t |
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)25℃时,生成1mol NO2,热量变化为56.4kJ,则生成2mol NO2,热量变化为112.8kJ,据此写出热化学方程式;
(5)根据化学反应速率的影响因素和化学平衡移动影响因素判断;
(6)根据反应物和生成物写出化学方程式;判断出氧化产物和还原产物,计算得到答案.
解答:
解(1)可逆反应2NO(g)+O2(g)?2NO2(g)的平衡常数k=
,故答案为:
;
(2)由方程式2NO(g)+O2(g)?2NO2(g)可知,平衡时△c(NO):△c(O2):△c(NO2)=2:1:2,由表中数据可知,平衡时△c(NO)=
=0.00625mol/L,曲线b平衡时的浓度为0.00625mol/L,故曲线b表示NO2的浓度变化,
由图中数据可知2s内,NO的浓度变化量为0.01mol/L-0.004mol/L=0.006mol/L,故v(NO)=
=0.003mol/(L?s),根据速率之比等于化学计量数之比,故v(O2)=
v(NO)=
×0.003mol/(L?s)=0.0015mol/(L?s),故答案为:b;0.0015mol/(L?s);
(3)A.未指明正逆速率,若都为同一方向速率,始终都存在v(NO2)=2v(O2)关系,故不能说明到达平衡,若为不同方向的速率,速率之比等于化学计量数之比,说明到达平衡,故A错误;
B.随反应进行气体的物质的量减小,压强增减小,容器内压强保持不变,说明到达平衡,故B正确;
C.不同物质表示的正逆速率之比等于化学计量数之比,反应到达平衡,故v逆(NO)=2v正(O2),说明到达平衡,故C正确;
D.反应混合气体的质量不变,容器的体积不变,密度始终不变,故容器内物质的密度保持不变,不能说明到达平衡,故D错误;
故选BC;
(4)25℃时,生成1mol NO2,热量变化为56.4kJ,则生成2mol NO2,热量变化为112.8kJ,据此写出热化学方程式为:2NO(g)+O2(g)?2NO2(g)△H=-112.8KJ/mol,故答案为:2NO(g)+O2(g)?2NO2(g)△H=-112.8KJ/mol;
(5)A.及时分离除NO2气体,浓度降低,化学反应速率减小,故A错误;
B.正反应为放热反应,升高温度,化学平衡向逆反应方向移动,故B错误;
C.增大O2的浓度,增大反应速率,且化学平衡向正反应方向移动,故C正确;
D.选择高效催化剂,只增大化学反应速率,不影响化学平衡移动,故D错误;
故选C;
(6)反应物为NH3和NO,发生氧化还原反应,可得到产物为:N2和H2O,化学方程式为:4NH3+6NO
5N2+6H2O;氧化产物和还原产物均为N2,氧化产物与还原产物之差为0.15mol,即NH3和NO物质的量之差为:0.15mol,且NH3和NO物质的量之比为4:6,可知NH3和NO物质的量分别为:0.3mol和0.45mol,则生成N2物质的量为:0.3mol×
=0.75mol,标况下体积为:0.75mol×22.4L/mol=16.8L,故答案为:4NH3+6NO
5N2+6H2O;16.8L.
| c2(NO2) |
| c2(NO)?c(O2) |
| c2(NO2) |
| c2(NO)?c(O2) |
(2)由方程式2NO(g)+O2(g)?2NO2(g)可知,平衡时△c(NO):△c(O2):△c(NO2)=2:1:2,由表中数据可知,平衡时△c(NO)=
| 0.02mol-0.007mol |
| 2L |
由图中数据可知2s内,NO的浓度变化量为0.01mol/L-0.004mol/L=0.006mol/L,故v(NO)=
| 0.006mol/L |
| 2s |
| 1 |
| 2 |
| 1 |
| 2 |
(3)A.未指明正逆速率,若都为同一方向速率,始终都存在v(NO2)=2v(O2)关系,故不能说明到达平衡,若为不同方向的速率,速率之比等于化学计量数之比,说明到达平衡,故A错误;
B.随反应进行气体的物质的量减小,压强增减小,容器内压强保持不变,说明到达平衡,故B正确;
C.不同物质表示的正逆速率之比等于化学计量数之比,反应到达平衡,故v逆(NO)=2v正(O2),说明到达平衡,故C正确;
D.反应混合气体的质量不变,容器的体积不变,密度始终不变,故容器内物质的密度保持不变,不能说明到达平衡,故D错误;
故选BC;
(4)25℃时,生成1mol NO2,热量变化为56.4kJ,则生成2mol NO2,热量变化为112.8kJ,据此写出热化学方程式为:2NO(g)+O2(g)?2NO2(g)△H=-112.8KJ/mol,故答案为:2NO(g)+O2(g)?2NO2(g)△H=-112.8KJ/mol;
(5)A.及时分离除NO2气体,浓度降低,化学反应速率减小,故A错误;
B.正反应为放热反应,升高温度,化学平衡向逆反应方向移动,故B错误;
C.增大O2的浓度,增大反应速率,且化学平衡向正反应方向移动,故C正确;
D.选择高效催化剂,只增大化学反应速率,不影响化学平衡移动,故D错误;
故选C;
(6)反应物为NH3和NO,发生氧化还原反应,可得到产物为:N2和H2O,化学方程式为:4NH3+6NO
| ||
| 5 |
| 2 |
| ||
点评:本题考查平衡常数即影响因素、化学反应速率、影响化学平衡的元素与平衡状态的判断等,难度中等,注意平衡状态判断选择判断的物理量,应随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.

练习册系列答案
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目
下列表示物质结构的化学用语或模型正确的是( )
A、对硝基甲苯的结构简式: |
B、CH4分子的球棍模型: |
C、醛基的电子式: |
| D、葡萄糖的最简式(实验式):CH2O |
下列说法正确的是( )
A、高聚物脲醛树脂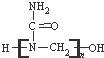 的合成单体之一是CH3OH 的合成单体之一是CH3OH |
B、按系统命名法,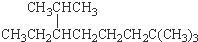 的名称为2,7,7-三甲基-3-乙基辛烷 的名称为2,7,7-三甲基-3-乙基辛烷 |
| C、有一种信息素的结构简式为CH3(CH2)5CH═CH(CH2)9CHO,为验证该物质中既含有醛基又含有碳碳双键,向该物质的试液中先加溴的CCl4溶液,观察到溶液褪色,继续滴加直到溶液变为红棕色,再向溶液中加入0.5mL H2O,充分振荡,观察到溶液褪色 |
D、化合物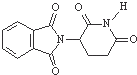 的分子式为C13H8O4N2 的分子式为C13H8O4N2 |
下列说法正确的是( )
| A、纸层析法分离铁离子和铜离子的实验中,应沿试管壁小心地将展开剂慢慢倒入试管底部 |
| B、硫酸铜溶液中加入过量浓氨水,最终溶液中出现大量淡蓝色絮状沉淀 |
| C、在氯化铝溶液中分别加入过量的氢氧化钠溶液和浓氨水,均可形成铝的配合物Al(OH)4- |
| D、在盛有氯化钴溶液的试管中,加入一定量的浓盐酸,溶液的颜色由粉红色变为蓝色 |
下列物质中,不能发生消去反应的是( )
A、 |
| B、CH2BrCH2Br |
C、 |
| D、CH2═CHBr |
下列叙述正确的是( )
| A、将SO2通入BaCl2溶液中至饱和,无沉淀产生,再通入SO2,产生沉淀 |
| B、称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液,充分反应后放出氢气的体积(同温同压下)相等 |
| C、向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而向Na2CO3溶液中滴入Ba(OH)2溶液出现白色沉淀 |
| D、某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,产生白色沉淀,则原溶液中一定含有SO42- |
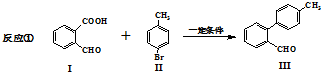
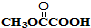 与
与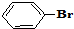 也可以发生类似反应①的反应,有机产物的结构简式为
也可以发生类似反应①的反应,有机产物的结构简式为 A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知: