题目内容
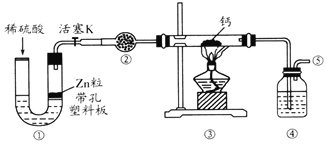
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用要求处理锂电池废料以节约资源、保护环境。锂离子二次电池正极铝钴膜主要含有LiCoO2、A1等,处理该废料的一种工艺如下图所示:
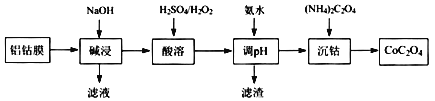
回答下列问题:
(l) Li元素在元素周期表中的位置为____________,LiCoO2中Co的化合价是____。
(2)“碱浸”时Al溶解的离子方程式为________。
(3)“酸溶”时加入H2O2的目的是____,调节pH后所得滤渣主要为____。
(4)“沉钴”的离子方程式为________。
(5)配制100 mL l.0 mol/L (NH4)2C2O4溶液,需要的玻璃仪器除玻璃棒、烧杯外,还需要_________。
(6)取CoC2O4固体4.41 g在空气中加热至300℃,得到钴的氧化物2.41 g,则该反应的化学方程式为 _________________。
【答案】第2周期IA族 +3 2Al+2OH-+2H2O=2AlO2-+3H2↑ 将 LiCoO2中的 Co(Ⅲ) 还原为+2 价 LiOH Co2++C2O4 2-=CoC2O4↓ 100 mL 容量瓶、胶头滴管 3CoC2O4+2O2 ![]() Co3O4+6CO2
Co3O4+6CO2
【解析】
由流程可知,加入NaOH碱液浸泡,将Al充分溶解,过滤后得到的滤液含有偏铝酸钠,滤渣为LiCoO2;加硫酸、过氧化氢发生2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,加入氨水调节溶液pH,除去锂离子,滤渣主要为LiOH,用草酸铵“沉钴”发生CoC2O4,以此来解答。
(1)Li的原子结构示意图为![]() ,则Li元素在元素周期表中的位置为第2周期IA族;LiCoO2中Co的化合价是0-(+1)-(-2)×2=+3;
,则Li元素在元素周期表中的位置为第2周期IA族;LiCoO2中Co的化合价是0-(+1)-(-2)×2=+3;
(2)“碱浸”时Al溶解的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)“酸溶”时加入H2O2的目的是将LiCoO2中的Co(Ⅲ) 还原为+2价,调节pH后所得滤渣主要为LiOH;
(4)“沉钴”的离子方程式为Co2++C2O42-═CoC2O4↓;
(5)配制100 mL1.0 mol/L(NH4)2C2O4溶液,需要的玻璃仪器除玻璃棒、烧杯外,还需要100 mL容量瓶、胶头滴管;
(6)取CoC2O4固体4.41 g在空气中加热至300℃,得到钴的氧化物2.41 g,n(CoC2O4)=![]() =0.03mol,氧化物为Co3O4时其物质的量为
=0.03mol,氧化物为Co3O4时其物质的量为![]() =0.01mol,则该反应的化学方程式为3CoC2O4+2O2
=0.01mol,则该反应的化学方程式为3CoC2O4+2O2 ![]() Co3O4+6CO2。
Co3O4+6CO2。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案【题目】探究![]() 反应的速率影响因素,设计了以下实验。下列说法正确的是
反应的速率影响因素,设计了以下实验。下列说法正确的是
锥形瓶标号 |
| 蒸馏水 |
| 反应温度 | 浑浊出现时间 | 备注 |
1 |
| 0 mL | 10 mL |
| 10s | |
2 | 10mL | 5mL | 5 mL |
| 16 s | |
3 | 10mL | 0mL | 10 mL |
| 5 s | 第10s开始浑浊不再增多 |
4 | 10mL | 4mL |
| 8s |
A.该反应也可通过测![]() 的体积变化来表示化学反应速率的快慢
的体积变化来表示化学反应速率的快慢
B.3号瓶用![]() 来表示速率为
来表示速率为![]()
C.由2号瓶和3号瓶实验结果可得温度越高反应速率越快
D.由1号瓶和4号瓶实验结果可得温度越高反应速率越快
【题目】一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.0~4min的平均反应速率:v(H2O2)>3.3×10-2mol·L-1·min-1
C.反应至6 min时,H2O2分解了50%
D.反应至6 min时,c(H2O2)=0.25 mol/L
【题目】氮元素可形成多种化合物,在工业生产中具有重要价值。 请回答下列问题:
(1)已知拆开1molH-H 键,1molN-H键, 1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应合成NH3的热化学方程式为___________________________________。
(2)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g) ![]() 2NH3(g),下列说法能说明上述反应达到平衡的是___________(填序号)。
2NH3(g),下列说法能说明上述反应达到平衡的是___________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成n mol N≡N键
③N2、H2、NH3的物质的量浓度之比为1∶3∶2
④混合气体的平均摩尔质量不变。
⑤容器内的气体密度不变
(3)一定温度下,2L密闭容器中充入0.40 mol N2O4,发生反应:N2O4(g) ![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
C(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①升高温度时,气体颜色加深,则正反应是_________(填“放热”或“吸热”)反应。
②该温度下反应的化学平衡常数数值为_____________。
③相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后: c(NO2) ______ 0.60mol·L-1(填“>”、 “=”或“<”)
(4)N2O5是一种新型硝化剂,其性质和制备受人们关注。现以 H2、O2、熔融盐 Z(Na2CO3)组成的燃料电池电解制备N2O5,装置如图所示,其中Y为CO2。
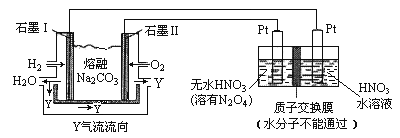
①写出石墨I电极上发生反应的电极反应式 _______________________________________;
②在电解池中生成N2O5的电极反应式为_______________________________________