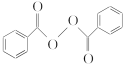
题目内容
【题目】如图1,将2 mol SO2和1 mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g);△H<0。当反应进行到时间 t0时达到平衡状态,测得混合气体的总物质的量为2.1 mol。 试回答:
2SO3(g);△H<0。当反应进行到时间 t0时达到平衡状态,测得混合气体的总物质的量为2.1 mol。 试回答:

(1)t0时SO3的物质的量为:____________,在图2中作出反应混合物中各组分气体的物质的量随反应进行到t0时的变化曲线____________;
(2)当反应进行到t1时间时(t1>t0),给上述反应容器加热到温度为T2 (T2>T1),反应在t3时(t3>t1)重新达到平衡状态,新平衡混合物中气体的总物质的量________2.1 mol(填“<”、“>”或“=”)。
(3)如图1所示,若起始时在容器中加入0.6 mol SO2、0.3 mol O2 ,保持温度不变,达到平衡状态后,SO3气体的体积分数与上述平衡相比__________(填“<”、“>”或“=”)。。
(4)V2O5是上述反应的催化剂,催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式________,_______;
【答案】1.8mol  > = SO2+ V2O5=SO3+2VO2 4VO2+ O2=2V2O5
> = SO2+ V2O5=SO3+2VO2 4VO2+ O2=2V2O5
【解析】
(1)设达到平衡时生成SO3的物质的量为xmol;
2SO2 + O2![]() 2SO3
2SO3
起始 2 mol 1 mol 0
转化 xmol ![]() mol x mol
mol x mol
平衡 (2-x)mol (1-![]() ) mol x mol
) mol x mol
据题意:(2-x) mol+(1-![]() ) mol+x mol=2.1 mol,解得x=1.8。(2)正反应放热,升高温度平衡逆向移动;(3)恒温、恒压,若起始时在容器中加入0.6 mol SO2、0.3 mol O2 ,则新平衡与原平衡是等效平衡;(4)V2O5氧化SO2时,自身被还原为四价钒氧化物,SO2被氧化为SO3;四价钒氧化物再被氧气氧化为V2O5。
) mol+x mol=2.1 mol,解得x=1.8。(2)正反应放热,升高温度平衡逆向移动;(3)恒温、恒压,若起始时在容器中加入0.6 mol SO2、0.3 mol O2 ,则新平衡与原平衡是等效平衡;(4)V2O5氧化SO2时,自身被还原为四价钒氧化物,SO2被氧化为SO3;四价钒氧化物再被氧气氧化为V2O5。
(1)设达到平衡时生成SO3的物质的量为xmol;
2SO2 + O2![]() 2SO3
2SO3
起始 2 mol 1 mol 0
转化xmol ![]() mol x mol
mol x mol
平衡 (2-x)mol (1-![]() ) mol x mol
) mol x mol
据题意:(2-x) mol+(1-![]() ) mol+x mol=2.1 mol,解得x=1.8。
) mol+x mol=2.1 mol,解得x=1.8。
t0时SO3的物质的量为1.8mol,SO2 的物质的量由2变为0.2、O2的物质的量由1变为0.1、SO3的物质的量由0变为1.8,反应混合物中各组分气体的物质的量随反应进行到t0时的变化曲线为 ;(2)正反应放热,升高温度平衡逆向移动,所以新平衡混合物中气体的总物质的量>2.1 mol;(3)恒温、恒压,若起始时在容器中加入0.6 mol SO2、0.3 mol O2 ,则新平衡与原平衡是等效平衡;达到平衡状态后,SO3气体的体积分数与上述平衡相相等;(4)V2O5氧化SO2时,自身被还原为四价钒氧化物,SO2被氧化为SO3;四价钒氧化物再被氧气氧化为V2O5,根据得失电子守恒,反应方程式是SO2+ V2O5=SO3+2VO2 、 4VO2+ O2=2V2O5。
;(2)正反应放热,升高温度平衡逆向移动,所以新平衡混合物中气体的总物质的量>2.1 mol;(3)恒温、恒压,若起始时在容器中加入0.6 mol SO2、0.3 mol O2 ,则新平衡与原平衡是等效平衡;达到平衡状态后,SO3气体的体积分数与上述平衡相相等;(4)V2O5氧化SO2时,自身被还原为四价钒氧化物,SO2被氧化为SO3;四价钒氧化物再被氧气氧化为V2O5,根据得失电子守恒,反应方程式是SO2+ V2O5=SO3+2VO2 、 4VO2+ O2=2V2O5。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧锰矿粉制备高纯度碳酸锰的工艺流程如下:

已知:①锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+) ═ 0.1 mol L -1形成M(OH) n沉淀的pH范围如下:

③常温下,Ksp(CaF2) ═1.46×10-10 Ksp(MgF2) ═7.42×10-11 Ka(HF) ═1.00 ×10-4
回答下列问题:
(1)分析下列图1、图2,氯化铵焙烧锰矿粉的最佳条件是:__________________。

(2)“焙烧”时发生的主要反应的化学方程式为_________________________。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为__________;再调节溶液的pH将Al3+、Fe3+变为沉淀除去;然后加入NH4F将Ca2+、Mg2+沉淀除去,此时溶液pH为6,c(Mg2+)═4.64×10-6 mol·L-1,c(HF)为_________mol·L-1。
(4)碳化结晶时,反应的离子方程式为_____________________________________。
(5)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是___________________。
(6)测定碳酸锰产品的纯度。
称取0.5000 g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+ ═Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
滴定次数 | 0.2000 mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
则产品的纯度=__________,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度___(填“偏高”“ 偏低”或“无影响”)。