题目内容
在一定温度下,在一体积固定的密闭中加入2mol X和1mol Y,发生如下反应:
2X(g)+Y(g) aZ(g)+W(g) △H=-Q kJ·mol-1(Q>0)(a是正整数)当反应达到平衡后,反应放出的热量为
aZ(g)+W(g) △H=-Q kJ·mol-1(Q>0)(a是正整数)当反应达到平衡后,反应放出的热量为
Q1kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值_______________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为______________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?___________,其理由是__________________________________。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是_____________(稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W
D.2 molX、1mol Y、lmolZ
(5)X的转化率α=_____________(用含Q、Q1的代数式表示)。
2X(g)+Y(g)
 aZ(g)+W(g) △H=-Q kJ·mol-1(Q>0)(a是正整数)当反应达到平衡后,反应放出的热量为
aZ(g)+W(g) △H=-Q kJ·mol-1(Q>0)(a是正整数)当反应达到平衡后,反应放出的热量为Q1kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值_______________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为______________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?___________,其理由是__________________________________。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是_____________(稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W
D.2 molX、1mol Y、lmolZ
(5)X的转化率α=_____________(用含Q、Q1的代数式表示)。
(1)减小
(2)1
(3)正确;2molX和1molY不可能完全反应
(4)A
(5)
(2)1
(3)正确;2molX和1molY不可能完全反应
(4)A
(5)


练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目

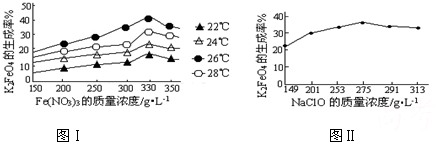
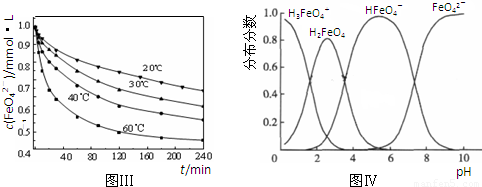
 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
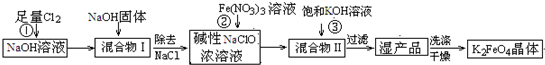


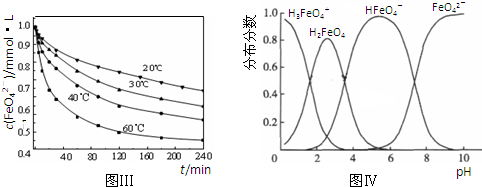
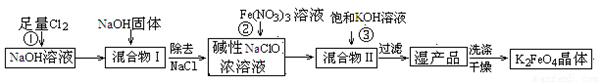
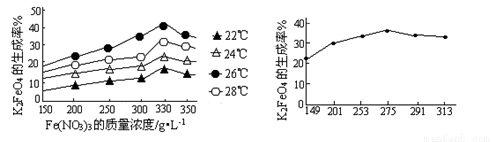
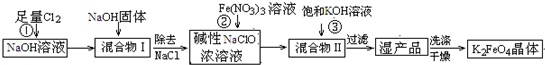
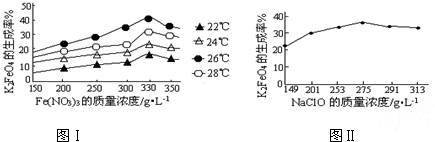
 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用______溶液(填序号).
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用______溶液(填序号).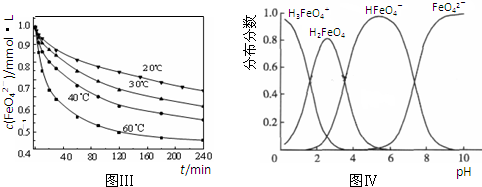
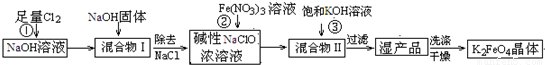
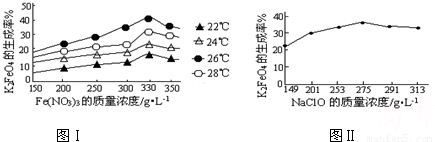
 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用______溶液(填序号).
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用______溶液(填序号).