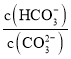题目内容
【题目】对下列现象或事实的解释正确的是![]()
选项 | 现象或事实 | 解释 |
A | 用热的纯碱溶液洗去油污 |
|
B | 漂白粉在空气中久置变质 | 漂白粉中的 |
C | 施肥时,草木灰 |
|
D | 钢铁在潮湿的空气中容易生锈 | 钢铁在空气中发生了析氢腐蚀 |
A.AB.BC.CD.D
【答案】C
【解析】
![]() 油脂在碱性溶液中水解生成溶于水的物质,碳酸钠溶液水解生成氢氧化钠显碱性,
油脂在碱性溶液中水解生成溶于水的物质,碳酸钠溶液水解生成氢氧化钠显碱性,![]() 不可直接与油污反应,故A错误;
不可直接与油污反应,故A错误;
B.漂白粉中有效成分次氯酸钙,其和空气中二氧化碳、水反应生成次氯酸和碳酸氢钙,次氯酸见光分解,漂白粉失效,故B错误;
C.碳酸钾和氯化铵在溶液中水解促进生成氨气,降低肥效,施肥时,草木灰![]() 有效成分为
有效成分为![]() 不能与
不能与![]() 混合使用,故C正确;
混合使用,故C正确;
D.钢铁在中性、弱酸性环境下发生吸氧腐蚀,故D错误;
答案选C。

 名师指导期末冲刺卷系列答案
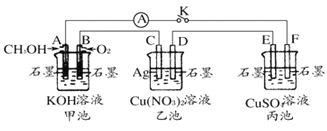
名师指导期末冲刺卷系列答案【题目】Ⅰ.(1)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36。请用离子方程式说明上述除杂的原理__。
(2)在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则该温度下水的离子积常数KW=__。在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=___。
Ⅱ.工业生成尿素的原理是以NH3和CO2为原料合成尿素,反应的化学方程式为2NH3(g)+ CO2(g)![]() CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
(1)ΔH___0(填“>”、“<”或“=”)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)n(NH3)∶n(CO2)=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___。
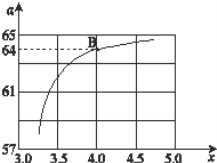
(3)图中的B点对应的NH3的平衡转化率为__。