题目内容
用pt电极电解某二价过渡金属元素的硝酸盐溶液600mL,当某极生成标准状况下的气体672mL时,另一极增重3.81g,若溶液的体积变化忽略且原溶液的pH=6,则下列说法正确的是(已知lg2=0.3)( )
| A、电解后溶液的pH为1.7 |
| B、电解后溶液的pH为0.7 |
| C、该金属的相对原子质量是65 |
| D、以上结论均不正确 |
考点:电解原理
专题:电化学专题
分析:用pt电极电解某二价过渡金属元素的硝酸盐溶液,阳极是氢氧根离子放电,阴极是金属离子放电,据电子守恒解答.
解答:
解:阳极是氢氧根离子放电,电极反应式为4OH--4e-=2H2O+O2↑,生成672mL氧气,即0.03mol,反应掉氢氧根离子0.12mol,生成0.12mol氢离子,氢离子物质的量浓度为:
=0.2mol/L,pH=-lgc(H+)=-lg2×10-1=1-0.3=0.7;
转移电子0.12mol,阴极电极反应式为M2++2e-=M,所以生成金属M的物质的量为0.06mol,其摩尔质量为
=63.5g/mol,
故选B.
| 0.12mol |
| 0.6L |
转移电子0.12mol,阴极电极反应式为M2++2e-=M,所以生成金属M的物质的量为0.06mol,其摩尔质量为
| 3.81g |
| 0.06mol |
故选B.
点评:本题据电子守恒法考查了电解后溶液的pH以及金属的相对原子质量,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、含有肽键的有机化合物遇到双缩脲试剂会产生紫玫瑰色,葡萄糖与新制氢氧化铜悬浊液混合出现绛蓝色 |
B、2,3-二甲基戊醛的键线式为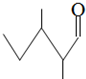 |
C、化合物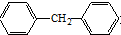 是苯的同系物 是苯的同系物 |
D、S-诱抗素的结构简式为: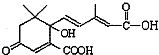 则l mol S-诱抗素与氢氧化钠溶液反应时,最多消耗3 mol NaOH 则l mol S-诱抗素与氢氧化钠溶液反应时,最多消耗3 mol NaOH |
下列离子方程式改写成化学方程式正确的是( )
| A、Cu2++2OH-=Cu(OH)2↓ CuCO3+2NaOH=Cu(OH)2↓+Na2CO3 |
| B、CO32-+2H+=CO2+H2O BaCO3+2HCl=BaCl2+CO2+H2O |
| C、Ca2++CO32-=CaCO3↓ Ca(NO3)2+Na2CO3=CaCO3↓+NaNO3 |
| D、H++OH-=H2O 2KOH+H2SO4=K2SO4+2H2O |
关于钠的叙述中,正确的是(( )
| A、钠是银白色金属,硬度很大 |
| B、钠燃烧时发出黄色火焰 |
| C、金属钠在空气中燃烧,生成氧化钠 |
| D、金属钠的熔点很高 |
某无色透明的溶液中加入铝粉能放出氢气,此溶液中一定能大量共存的离子组是( )
| A、H+、Cu2+、Cl-、SO42- |
| B、HCO3-、NO3-、SO42-、Na+ |
| C、Cl-、SO42-、K+、Na+ |
| D、Ca2+、SO42-、CO32-、Cl- |