题目内容
(14分)广东省海水资源丰富,海水中主要含![]()
![]() 等离子。合理利用海水资源和保护环境是我省可持续发展的重要保证。
等离子。合理利用海水资源和保护环境是我省可持续发展的重要保证。
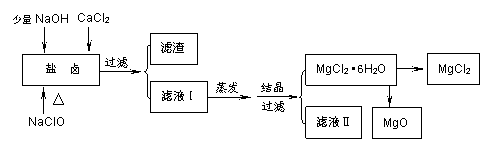
I:火力发电是广东的重要能源,但是烧煤排放的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:

(l)天然海水的pH≈8,呈弱碱性。用离子方程式解释原因_(任写一个)。
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其原理化学反应方程式是 ;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是
II:重金属离子对河流海洋造成严重污染。某化工厂废水(pH=2.0,d≈1 g?mL-1)中
含有Ag+, Pb 2+等重金属离子,其浓度各约为O.Olmol?L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:

(3)你认为往废水中投入_(填字母序号),沉淀效果最好。
A. NaOH B.Na2S C.KI D. Ca(OH)2
(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=_。
(5)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为c (Ag+)低于1.0X10一5mol ?L-1,问该工厂处理后的废水中Ag+.是否符合排放标准?要求写出计算过程。已知Ksp (AgCl) =1.8X10-10 mol2?L-1
Ⅰ: (每空2分,方程式错一处均不给分)
(1)CO32-+H2O![]() HCO3-+OH-或 HCO3-+H2O
HCO3-+OH-或 HCO3-+H2O![]() H2CO3 +OH-
H2CO3 +OH-
(2)2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42- (任写一个化学方程式或离子方程式均给分) 中和、稀释经氧气氧化后海水中生成的酸(H+)
Ⅱ:
(3)B(2分)
(4)1.2×10-3 mol?L-1(2分)
(5)处理后的废水中Cl-的物质的量浓度为:
C(Cl-)= ![]() (2分)
(2分)
当反应达到AgCl的沉淀溶解平衡后,由Ksp(AgCl)=[Ag+]?[Cl-]可
[Ag+]=![]()
答:Ag+符合排放标准。(2分)