题目内容
19. 如图所示为CH4燃料电池的装置(A、B为多孔碳棒):
如图所示为CH4燃料电池的装置(A、B为多孔碳棒):(1)B(填A或B)处电极入口通甲烷,其电极反应式为CH4-8e-+10OH-═CO32-+7H2O;
(2)当消耗甲烷的体积为11.2L(标准状况下)时,消耗KOH的质量为56g.
分析 (1)根据电子流向知,B为负极、A为正极,燃料电池中通入燃料的电极为负极、通入氧化剂的电极为正极,甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
(2)根据甲烷和转移电子、氢氧化钾之间的关系式计算.
解答 解:(1)根据电子流向知,B为负极、A为正极,燃料电池中通入燃料的电极为负极、通入氧化剂的电极为正极,所以B处通入甲烷,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4-8e-+10OH-═CO32-+7H2O,故答案为:B;CH4-8e-+10OH-═CO32-+7H2O;
(2)由CH4+2O2+2KOH═K2CO3+3H2O知,消耗KOH的物质的量为甲烷物质的量的2倍,所以消耗氢氧化钾的物质的量是2×$\frac{11.2L}{22.4L/mol}$=1mol,所以质量为:1mol×56g/mol=56g,
故答案为:56.
点评 本题考查了原电池和电解池原理,燃料是发生氧化反应作原电池的负极,根据方程式中各个物理量之间的关系式进行计算,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.某有机物的结构简式如图所示,则下列有关说法正确的是( )


| A. | 该有机物可以发生氧化、加成、加聚、取代等反应 | |
| B. | 该有机物能与NaOH溶液反应,则1mol该有机物能消耗2molNaOH | |
| C. | 该有机物的分子式为C12H12O5,且与C11H10O5 一定互为同系物 | |
| D. | 该有机物分子中所有碳原子不可能都在同一平面上 |
10.下列给出的有机物属于饱和烃的为( )
| A. | CCl4 | B. | C2H6 | C. | CH4 | D. | H2C═CH2 |
7.反应4A(g)+3B(g)?2C(g)+D(g),达到平衡时,下列说法正确的是( )
| A. | A、B全部变成了C和D | B. | B的正反应速率和逆反应速率相等 | ||
| C. | 反应已经停止 | D. | A、B、C、D四种物质的浓度一定相等 |
14.氡(Rn)是放射性元素,某些建筑材料中若含有氡,将对人体健康造成危害.222Rn来自镭而称之为镭射气,220Rn来自钍而称之为钍射气,219Rn来自锕而称之为锕射气.下列有关氡的说法正确的是( )
| A. | 氡气是双原子分子 | |
| B. | 氡气因其化学性质活泼而对人体有害 | |
| C. | 氡元素有222Rn、220Rn、219Rn三种同素异形体 | |
| D. | 氡的原子核外有6个电子层,最外层有8个电子 |
4.下列有关性质比较不正确的是( )
| A. | 晶体熔点的高低: | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
11.下列说法错误的是( )
| A. | 改变压强不一定改变反应速率 | |
| B. | 使用催化剂能同时增大正、逆反应的速率,并改变化学反应的限度 | |
| C. | 固体物质的状态(如块状、粉末状等)对反应速率有影响 | |
| D. | 升高温度一定能增大反应速率 |
8.下列说法不正确的是( )
| A. | 研究物质在水溶液中的反应,溶液是环境,盛溶液的烧杯和溶液之外的空气等便是体系 | |
| B. | 能源的开发和利用可以用来衡量一个国家或地区的经济发展和科学技术水平 | |
| C. | 催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol KOH的溶液混合,放出的热量大于57.3kJ |
9.海洋中有丰富的食品、矿产、能源、药物和水产资源.下图是从海水中提取某些原料的.
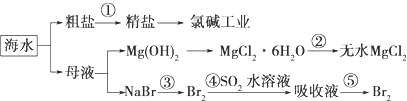
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液-→过滤后加盐酸 | |
| B. | 从第③步到第⑤步的目的是浓缩、富集溴 | |
| C. | 第①到第⑤步中,涉及到氧化还原反应共有2步 | |
| D. | 第④步中,SO2起氧化作用 |