题目内容
5.已知酸性强弱顺序为 ,则下列化学方程式中正确的是( )
,则下列化学方程式中正确的是( )
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
分析 ①.由于酸性 ,苯酚钠与二氧化碳反应生成的是碳酸氢根离子;
,苯酚钠与二氧化碳反应生成的是碳酸氢根离子;
②.由于酸性 ,反应生成苯酚钠和碳酸氢钠;
,反应生成苯酚钠和碳酸氢钠;
③.苯酚的酸性小于碳酸,无法实现碳酸氢钠制取碳酸;
④.酸性 ,苯酚可制得碳酸氢钠.
,苯酚可制得碳酸氢钠.
解答 解:①.由于酸性 ,故苯酚钠可与二氧化碳和水反应生成了碳酸氢钠,方程式为
,故苯酚钠可与二氧化碳和水反应生成了碳酸氢钠,方程式为 ,故①正确;
,故①正确;
②.由①分析可知, ,故②错误;
,故②错误;
③.由于苯酚的酸性小于碳酸,苯酚不可能反应生成碳酸,该反应不能发生,故③错误;
④.酸性 ,苯酚可制得碳酸氢钠,反应为
,苯酚可制得碳酸氢钠,反应为 ,故④正确;
,故④正确;
故选C.
点评 本题主要考查了强酸制弱酸的反应原理,题目难度中等,试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
13.常温下在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 能使pH试纸呈红色的溶液:Na+、NH4+、Fe2+、NO3- | |
| B. | 加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液:H+、Al3+、Cl-、SCN- | |
| D. | 使酚酞变红色的溶液:Na+、Ba2+、NO3-、Cl- |
10.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 一定条件下,0.2 mol SO2与足量O2充分反应,生成SO3分子数为0.2NA | |
| B. | 0.1 mol NH2-中含有的电子数为0.9NA | |
| C. | 3.4 g H2O2中含有的共用电子对数为0.1NA | |
| D. | 常温常压下,16 g O2和O3混合气体含有的氧原子数为NA |
17.用pH大小表示溶液的酸碱性相对强弱有许多不足之处,因此,荷兰科学家Hcnk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH-)比值的对数,酸度的计算公式表示为AG=lg[c(H+)/c(OH-)],常温下,在AG=1的溶液中能大量共存的离子是( )
| A. | Ca2+、K+、Cl-、NO3- | B. | NH4+、Fe3+、I-、SO42- | ||
| C. | Na+、K+、ClO-、S2- | D. | Na+、S2O32-、AlO2-、K+ |

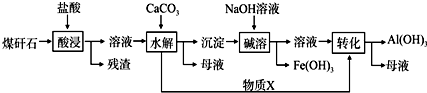
 .该工艺设计中,过量X参与反应的离子方程式是:AlO2-+CO2+2H2O=Al(OH)3+HCO3-.
.该工艺设计中,过量X参与反应的离子方程式是:AlO2-+CO2+2H2O=Al(OH)3+HCO3-.