题目内容
19.下列各溶液中,离子的物质的量浓度关系正确的是( )| A. | pH=3的H2SO4溶液中:c(H+)=10-3mol•L-1 | |
| B. | 呈中性的醋酸和醋酸钠的混合溶液中:c(Na+)>c(CH3COO-) | |
| C. | 在Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 氯化铵溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
分析 A.根据c(H+)=10-pH计算出氢离子浓度;
B.中性溶液中c(H+)=c(OH-),根据电荷守恒可知c(Na+)=c(CH3COO-);
C.根据碳酸钠溶液中的物料守恒判断;
D.铵根离子部分水解,溶液稀释酸性,则c(H+)>c(OH-),根据电荷守恒可知c(Cl-)>c(NH4+).
解答 解:A.pH=3的H2SO4溶液中,氢离子浓度为:c(H+)=10-pHmol/L=10-3mol•L-1,故A正确;
B.呈中性的醋酸和醋酸钠的混合溶液中满足c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(CH3COO-),故B错误;
C.在Na2CO3溶液中,根据物料守恒可得:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故C错误;
D.氯化铵溶液中,铵根离子部分水解,溶液稀释酸性,则c(H+)>c(OH-),根据电荷守恒可知c(Cl-)>c(NH4+),则溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故D正确;
故选AD.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒、盐的水解原理为解答关键,试题侧重考查学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
10.欲将混合液中Al3+、Cu2+、Ba2+、Ag+逐一沉淀出来加以分离,加入试剂①Cl-②SO42- ③OH-④CO2⑤CO32-的正确顺序是( )
| A. | ①②③④ | B. | ③⑤①② | C. | ②①③⑤ | D. | ①⑤③② |
14.下列说法正确的是( )
| A. | Na2O2可作为潜艇工作人员的供氧剂 | |
| B. | 电解熔融NaCl可制得Na单质 | |
| C. | Fe3O4通常作为油漆原料 | |
| D. | 可用Ba(OH)2溶液区别NaHCO3溶液和Na2CO3溶液 |
11.下列关于化学用语的表示正确的是( )
| A. | 二氟化氧分子电子式: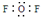 | |
| B. | 质子数与中子数相等的硫原子${\;}_{16}^{16}$S | |
| C. | 镁离子的结构示意图: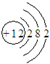 | |
| D. | 对甲基苯酚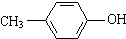 |
8.14g铜银合金与足的某浓度硝酸反应,将放出的气体与1.12L的氧气混合于烧瓶后再倒扣入水槽中,水恰好充满整个烧瓶,则合金中铜的质量为( )
| A. | 1.6g | B. | 0.32g | C. | 3.2g | D. | 6.4g |
 某学习小组拟以下列合成路线合成1-丁醇:CH3CH=CH2+CO+H2$\stackrel{一定条件}{→}$CH3CH2CH2CHO$→_{N/△}^{H_{2}}$CH3CH2CH2CH2OH
某学习小组拟以下列合成路线合成1-丁醇:CH3CH=CH2+CO+H2$\stackrel{一定条件}{→}$CH3CH2CH2CHO$→_{N/△}^{H_{2}}$CH3CH2CH2CH2OH
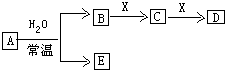 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去). ;
;