题目内容
11.下列离子方程式中,错误的是( )| A. | 钠和冷水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 将氯气通入水中:Cl2+H2O=Cl-+HClO+H+ | |
| D. | 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
分析 A.二者反应生成氢氧化钠和氢气;
B.一水合氨为弱碱,氯化铝与氨水反应生成氯化铝沉淀,不会生成偏铝酸根离子;
C.二者反应生成氯化氢和次氯酸,次氯酸为弱酸应保留化学式;
D.硝酸根离子在酸性环境下具有强的氧化性,能够氧化二价铁离子.
解答 解:A.钠和冷水反应,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A正确;
B.AlCl3溶液中加入足量的氨水,反应生成氢氧化铝沉淀,离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.将氯气通入水中,离子方程式为:Cl2+H2O=Cl-+HClO+H+,故C正确;
D.向Fe(NO3)2溶液中加入稀盐酸,离子方程式为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,故D正确;
故选:B.
点评 本题考查了离子方程式的正误判断,掌握离子方程式的书写原则,明确离子方程式正误判断常用方法是解题关键,注意离子反应遵循客观事实,题目难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
9. 甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
 甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 乙的单质在空气中燃烧生成只含离子键的化合物 | |
| C. | 丙与庚的原子核外电子数相差11 | |
| D. | 原子半径:辛>己>戊 |
6.下列各对物质中属于同分异构体的是( )
| A. | ${\;}_6^{12}$C与${\;}_6^{13}$C | B. | O2与O3 | ||
| C. |  与 与 | D. | 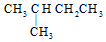 与 与 |
16.M元素的一个原子失去2个电子,这2个电子转移到Y元素的2个原子中去,形成离子化合物Z,下列说法中,正确的是( )
| A. | Z的熔点较低 | B. | Z可表示为M2Y | ||
| C. | M离子和Y离子的核外电子排布相同 | D. | M形成+2价阳离子 |
3.将二氧化硫通入下列试剂,能依次证明SO2具有还原性、漂白性、氧化性、酸性氧化物性质的是( )
①溴水
②品红溶液
③酸性高锰酸钾溶液
④硝酸钡溶液
⑤含酚酞的氢氧化钠溶液
⑥氢硫酸
⑦紫色石蕊试液
⑧氯化铁溶液.
①溴水
②品红溶液
③酸性高锰酸钾溶液
④硝酸钡溶液
⑤含酚酞的氢氧化钠溶液
⑥氢硫酸
⑦紫色石蕊试液
⑧氯化铁溶液.
| A. | ①⑤⑥④ | B. | ⑧②⑥⑤ | C. | ③⑦⑥⑤ | D. | ④②⑤① |
20.下列有关比较顺序中,正确的是( )
| A. | 熔点:金刚石>晶体硅>冰>干冰 | B. | 电负性:N>O>F | ||
| C. | 熔点:CsCl>MgO>Na>K | D. | 沸点:C2H5SH>C2H5OH>CH3SH |
15.海洋中有丰富的资源,按图所示工艺流程可利用海水获得Br2:下列描述不正确的是( )

| A. | 从海水中提取溴,一般要经历浓缩、氧化、还原富集和再氧化等步骤 | |
| B. | 利用溴的挥发性,鼓入热空气或水蒸气,就可将溴吹出来 | |
| C. | 第②步发生反应的离子方程式为:SO2+Br2+2H2O═4H++2Br-+SO42- | |
| D. | 要除去产品溴中的少量氯气,可依次加入NaOH溶液及苯 |
