题目内容
2.下列变化过程中,只破坏共价键的是( )| A. | I2升华 | B. | CaCO3颗粒被粉碎 | C. | HCl溶于水 | D. | NH4HCO3受热分解 |
分析 A.I2分子间存在分子间作用力;
B.CaCO3中存在离子键;
C.HCl中存在共价键;
D.NH4HCO3分解产生NH3、H2O和CO2
解答 解:A.I2升华只破坏分子间作用力,故A不选;
B.CaCO3颗粒粉碎破坏了离子键,故B不选;
C.HCl溶于水电离成H+和Cl-,只破坏共价键,故C选;
D.NH4HCO3分解产生NH3、H2O和CO2,既破坏离子键,又破坏共价键,故D不选;
故选C.
点评 本题难度不大,考查化学键与分子间作用力,熟悉常见物质中的元素及元素之间的成键是解答本题的关键,注意铵盐中存在离子键来分析解答.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
12.如表列出了前20号元素中的某些元素性质的一些数据:
(1)以上10种元素中,电负性最大的是O(填元素符号).
(2)写出下列有关反应的化学方程式:
①E的单质与I元素的最高价氧化物对应的水化物反应:C+4HNO3(浓)=CO2↑+4NO2↑+2H2O.
②B2C2与EC2反应:2K2O2+2CO2=2K2CO3+O2.
(3)A元素原子核外电子排布图是1s22s22p63s23p4;比元素B原子序数大11的元素的原子的电子排布式是1s22s22p63s23p63d104s2或者[Ar]3d104s2.
(4)C和I相比较,非金属性较弱的是氮(填元素名称).
| 元素 性质 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10 m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高 价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低 价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
(2)写出下列有关反应的化学方程式:
①E的单质与I元素的最高价氧化物对应的水化物反应:C+4HNO3(浓)=CO2↑+4NO2↑+2H2O.
②B2C2与EC2反应:2K2O2+2CO2=2K2CO3+O2.
(3)A元素原子核外电子排布图是1s22s22p63s23p4;比元素B原子序数大11的元素的原子的电子排布式是1s22s22p63s23p63d104s2或者[Ar]3d104s2.
(4)C和I相比较,非金属性较弱的是氮(填元素名称).
13.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.
(1)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(3)为了探究现象Ⅱ的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.资料显示:SCN-的电子式为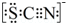 .
.
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
④若SCN-与Cl2反应生成1mol CO2,写出反应离子方程式SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,并计算转移电子的物质的量是16mol.
| 操 作 | 现 象 |
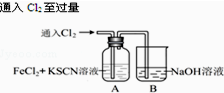 | I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(3)为了探究现象Ⅱ的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.资料显示:SCN-的电子式为
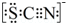 .
.①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
④若SCN-与Cl2反应生成1mol CO2,写出反应离子方程式SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,并计算转移电子的物质的量是16mol.
10.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+.取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中( )
| A. | Cl-一定存在,且c(Cl-)≥0.4 mol/L | |
| B. | SO42-、NH4+一定存在,Cl-可能不存在 | |
| C. | CO32-、Al3+一定不存在,K+可能存在 | |
| D. | 至少存在5种离子 |
17.下列实验装置正确且能达到实验目的是( )


| A. | 用图1所示装置制取少量Cl2 | |
| B. | 用图2所示装置证明非金属性Cl>C>Si | |
| C. | 图3所示装置中水不能持续流下,说明装置气密性良好 | |
| D. | 用图4所示装置测定镁铝合金中铝的质量分数 |
7.下列物质属于天然纤维且其主要成分是纤维素的是( )
| A. | 棉花 | B. | 光导纤维 | C. | 人造棉 | D. | 蚕丝 |
14.下列能与文字表述对应且正确的反应方程式是( )
| A. | 甲烷和氯气在光照条件下反应:2CH4+Cl2$\stackrel{光照}{→}$2CH3 Cl+H2 | |
| B. | 实验室用电石制乙炔:CaC2+2H2O→Ca(OH)2+HC≡CH↑ | |
| C. | 用NaOH溶液中和苯酚溶液的酸性:H++OH-═H2O | |
| D. | 向苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2 C6H5OH+CO32- |
11.下列物质中,属于天然高分子化合物的是( )
| A. | 硝化纤维 | B. | 硬脂酸 | C. | 淀粉 | D. | 聚乙烯 |
12.下列关于胶体的性质与应用的说法不正确的是( )
| A. | 静电除尘器除去空气或工厂废气中的飘尘是利用胶体粒子的带电性而加以除去 | |
| B. | 医学上的血液透析原理与胶体的渗析类似,透析膜与半透膜类似 | |
| C. | 从颜色上无法区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 由于胶休粒子之间的排斥作用,胶体粒子不易聚集成大的颗粒,所以胶体的性质相对比较稳定 |