题目内容
下列反应中,氧化剂与还原剂物质的量的关系不是1:2的是( )
| A、O3+2KI+H2O═2KOH+I2+O2 | ||||
| B、3NO2+H2O═2HNO3+NO | ||||
| C、3S+6NaOH═Na2SO3+2Na2S+3H2O | ||||
D、4HCl(浓)+MnO2
|
考点:氧化还原反应
专题:氧化还原反应专题
分析:氧化还原反应中化合价降低得电子的物质为氧化剂,化合价升高失电子的是还原剂,结合方程式判断.
解答:
解:A.O3+2KI+H2O═2KOH+I2+O2,反应中O3为氧化剂,KI为还原剂,则氧化剂与还原剂物质的量之比为1:2,故A不选;
B.3NO2+H2O═2HNO3+NO,反应中1molNO2得电子为氧化剂,2molNO2失电子为还原剂,则氧化剂与还原剂物质的量之比为1:2,故B不选;
C.3S+6NaOH═Na2SO3+2Na2S+3H2O反应中2molS得电子为氧化剂,1molNO2失电子为还原剂,则氧化剂与还原剂物质的量之比为2:1,故C选;
D.4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O,反应中1molMnO2得电子为氧化剂,2molHCl失电子为还原剂,则氧化剂与还原剂物质的量之比为1:2,故D不选.
故选C.
B.3NO2+H2O═2HNO3+NO,反应中1molNO2得电子为氧化剂,2molNO2失电子为还原剂,则氧化剂与还原剂物质的量之比为1:2,故B不选;
C.3S+6NaOH═Na2SO3+2Na2S+3H2O反应中2molS得电子为氧化剂,1molNO2失电子为还原剂,则氧化剂与还原剂物质的量之比为2:1,故C选;
D.4HCl(浓)+MnO2
| ||
故选C.
点评:本题考查氧化还原反应概念及计算,判断氧化剂、还原剂后,可以根据电子转移守恒计算氧化剂和还原剂的物质的量之比,难度不大.

练习册系列答案
相关题目
 在盛有足量M的体积可变的密闭容器中加入N,发生反应:M (s)+2N (g)═4P (s)+Q(g)△H<0.在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的转化关系如图所示.下列说法正确的是( )
在盛有足量M的体积可变的密闭容器中加入N,发生反应:M (s)+2N (g)═4P (s)+Q(g)△H<0.在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的转化关系如图所示.下列说法正确的是( )| A、平衡时N的转化率为50% |
| B、当温度升高后,则图中θ>450 |
| C、若再加入N,则正、逆反应速率均逐渐增大 |
| D、若在加入N,则反应体系中气体密度减小 |
锌锰干电池是生活中应用最广泛的电池,下列说法中不正确的是( )
| A、该电池正极反应式为:MnO2+H2O+e-=MnOOH+OH- |
| B、电池工作时负极pH一定降低 |
| C、用该电池作电源精炼铜,纯铜与锌连接 |
| D、用该电池作电源电解硫酸铜溶液,负极溶解6.5g锌,阴极一定析出6.4g铜 |
常温下,下列三个反应均能发生:X2+2W2+═2X-+2W3+;Z2+2X-═2Z-+X2;2W3++2Y-═2W2++Y2.则在相同条件下,下列三个反应:①Y2+2X-═2Y-+X2;②Z2+2Y-═2Z-+Y2;③2W3++2Z-═2W2++Z2也能发生的是( )
| A、只有① | B、只有② |
| C、①和② | D、②和③ |
28%的KOH溶液中,平均多少个水分子溶有一个K+( )
| A、6个 | B、8个 |
| C、10个 | D、28个 |
下列叙述正确的是( )
| A、足量的硫单质与64g铜反应,有2mol电子发生转移 |
| B、常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Kap(AgCl)增大 |
| C、0.1mol?L-1Na2CO3中加入少量NaOH固体振荡,c(Na+)和c(CO32-)都增大 |
| D、相同浓度的CH2COOH和CH2COONa溶液等体积混合后,则:c(CH2COO-)+c(CH2COOH)=c(Na+) |
下列反应的离子方程式书写错误的是( )
| A、向饱和Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B、次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO |
| C、1 L 2 mol?L-1的FeBr2溶液中通入2.5 mol Cl2:4Fe2++6Br-+5Cl2═10Cl-+4Fe3++3Br2 |
| D、在H2C2O4中加入酸性KMnO4溶液:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O |
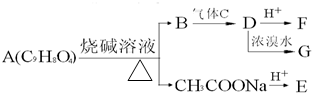 A为药用有机物,从A出发可发生如图所示的一系列反应.已知A在一定条件下能与醇发生酯化反应,A分子中的苯环上有两个取代基,且苯环上的一卤代物有两种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应.请回答下列问题:
A为药用有机物,从A出发可发生如图所示的一系列反应.已知A在一定条件下能与醇发生酯化反应,A分子中的苯环上有两个取代基,且苯环上的一卤代物有两种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应.请回答下列问题: