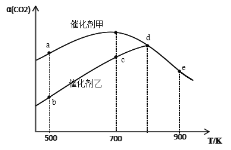
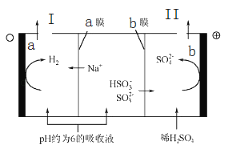
题目内容
【题目】设NA表示阿伏伽德罗常数,下列说法正确的是( )
A.16gO2与O3的混合气体中含有的原子数为NA
B.100g46%的乙醇(C2H5OH)溶液共含氢原子数6NA
C.7.8gNa2O2含有的离子数为0.4NA
D.0.1molFe在足量氧气中燃烧,转移电子数为0.3NA
【答案】A
【解析】
A.氧气和臭氧均由氧原子构成,故16g混合物中含有的氧原子的物质的量为![]() ,故含氧原子为
,故含氧原子为![]() 个,A正确;
个,A正确;
B.乙醇溶液中除了乙醇外,水也含H原子,故![]() 的乙醇溶液中含有的乙醇的质量为46g,物质的量为1mol,故含H原子为6mol,而水的质量=100g-46g=54g,物质的量为3mol,故含H原子为6mol,故共含H原子为
的乙醇溶液中含有的乙醇的质量为46g,物质的量为1mol,故含H原子为6mol,而水的质量=100g-46g=54g,物质的量为3mol,故含H原子为6mol,故共含H原子为![]() 个,B错误;
个,B错误;
C.![]() 过氧化钠的物质的量为
过氧化钠的物质的量为![]() ,而Na2O2由2个钠离子和1个过氧离子构成,故
,而Na2O2由2个钠离子和1个过氧离子构成,故![]() 过氧化钠中含离子为
过氧化钠中含离子为![]() 个,C错误;
个,C错误;
D.铁和氧气中燃烧生成四氧化三铁,平均每个Fe化合价升高了![]() ,1molFe反应电子转移
,1molFe反应电子转移![]() mol电子,故
mol电子,故![]() 铁反应后转移电子数=
铁反应后转移电子数=![]() ,D错误。
,D错误。
答案选A。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案【题目】碳酸二乙酯(![]() )常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
)常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
化学式 | 熔点/℃ | 沸点/℃ | 物理性质 |
COCl2 | -118 | 8.2 | 微溶于水,溶于芳烃、苯、四氯化碳、氯仿、乙酸等多数有机溶剂,遇水迅速水解,生成氯化氢 |
SO3 | 16.8 | 44.8 | 溶于水,并与水反应生成硫酸和放出大量的热 |
SO2Cl2 | -54.1 | 69.1 | 溶于乙酸、苯,与水反应生成H2SO4和HCl |
CCl4 | -22.9 | 76.8 | 微溶于水,易溶于多数有机溶剂 |
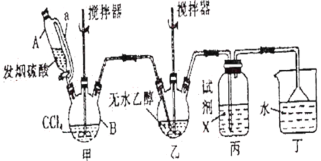
回答下列问题:
(1)甲装置主要用于制备光气(COCl2),先将仪器B中的四氯化碳加热至55~60℃,再缓缓滴加发烟硫酸。
①仪器B的名称是__________。
②仪器A的侧导管a的作用是__________。
(2)试剂X是__________,其作用是__________。
(3)丁装置除了吸收COCl2外,还能吸收的气体是__________(填化学式)。仪器B中四氯化碳与发烟硫酸(用SO3表示)反应只生成两种物质的量为1:1的产物,且均易与水反应,写出该反应化学方程式:__________。
(4)无水乙醇与光气反应生成氯甲酸乙酯,再继续与乙醇反应生成碳酸二乙酯。
①写出无水乙醇与光气反应生成氯甲酸乙酯的化学方程式:__________。
②若起始投入92.0g无水乙醇,最终得到碳酸二乙酯94.4g,则碳酸二乙酯的产率是__________(三位有效数字)
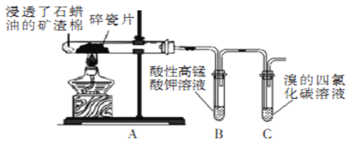
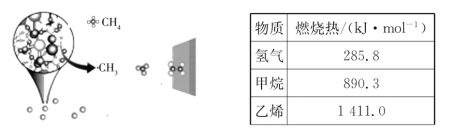
【题目】某同学用食用油进行实验,以下是实验操作和现象:
实验操作 | 将食用油滴入水中 | 向食用油中滴加溴水 | 将少量食用油与纯碱(主要成分是 |
实验现象 | 食用油浮在水面上 | 溴水褪色 | 分层现象消失 |
下列关于食用油的实验结论不正确的是( )
A.食用油的密度比水小
B.食用油中含碳碳不饱和键
C.食用油在碱性条件下会水解生成可溶于水的物质
D.食用油是一种有机酸