题目内容
9.下列说法正确的是( )| A. | 0.5molO3与11.2LO2所含的分子数一定相等 | |
| B. | 25℃与60℃时,水的pH相等 | |
| C. | 中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)相等 | |
| D. | 2SO2(g)+O2(g)=2SO3(g)和4SO2(g)+2O2(g)=4SO3(g)的△H相等 |
分析 A.没有指出标准状况下,无法计算氧气的物质的量;
B.温度不同,水电离出氢离子的浓度不同,则溶液的pH不相等;
C.盐酸和醋酸都是一元酸,二者物质的量相等时消耗氢氧化钠的物质的量相等;
D.焓变与化学计量数成正比,计量数不同则焓变不同.
解答 解:A.不是标准状况下,无法计算11.2LO2的物质的量,故A错误;
B.25℃与60℃时水的电离程度不同,水的pH=-lgc(H+),则水的pH不相等,故B错误;
C.等体积、等物质的量的浓度的盐酸和醋酸,两溶液含有HCl和醋酸的物质的量相等,二者都是一元酸,则与氢氧化钠溶液发生中和反应时消耗氢氧化钠溶液的物质的量相等,故C正确;
D.反应2SO2(g)+O2(g)=2SO3(g)和4SO2(g)+2O2(g)=4SO3(g)的化学计量数不同,则两个反应的△H一定不相等,故D错误;
故选C.
点评 本题考查了物质的量的计算,题目难度不大,涉及pH计算、反应热与焓变、中和反应、物质的量的计算等知识,A为易错点,注意明确标准状况下气体摩尔体积的使用条件,试题侧重考查学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
19.在容积为2L的容器内,发生反应2A(s)+3B(g)?2C(g)+D(g),△H<0起始时充入3molA和2.5molB混合气体,经过5min生成0.5molD,下列说法正确的是( )
| A. | B的平均消耗速率为0.3mol/(L•min) | |
| B. | 升高温度时,v正减小,v逆增大 | |
| C. | 若单位时间内生成的B和D的物质的量之比为3:1,则体系处于平衡状态 | |
| D. | 平衡后,增大压强,平衡将向正方向移动 |
20.下列叙述正确的是 ( )
| A. | “接触法”制H2SO4时,催化氧化阶段的反应原理为:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0 | |
| B. | 海水提镁的主要步骤为:海水$\stackrel{CaCO_{3}(s)}{→}$Mg(OH)2(s)$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg(l)+Cl2(g) | |
| C. | 普通水泥的主要成分是硅酸钙 | |
| D. | 黏土的主要成分是三氧化二铝. |
17.CCTV《科技博览》曾经报道中科院首创用二氧化碳合成可降解塑料:聚二氧化碳.下列相关说法合理的是( )
| A. | 使用聚二氧化碳塑料会产生白色污染 | |
| B. | 聚二氧化碳塑料是通过聚合反应制得的 | |
| C. | 聚二氧化碳塑料与干冰互为同分异构体 | |
| D. | 聚二氧化碳塑干冰都属于纯净物 |
4.下列化学实验操作、现象及所得结论均正确的是( )
| 实验操作 | 实现现象 | 结论 | |
| A | 用饱和碳酸钠溶液浸泡锅炉沉积物后,过滤,洗涤,在所得沉淀物中再加入稀盐酸 | 有气泡产生 | 可除去锅炉沉淀物中的CaSO4 |
| B | 某充满NO2的密闭容器中,待反应平衡后,保持温度不变,扩大容器体积 | 气体颜色变浅 | 平衡2NO2(g)?N2O4(g)正向移动 |
| C | 向品红溶液中通入某气体 | 溶液褪色 | 该气体是SO2 |
| D | 用洁净铂丝蘸取溶液置于酒精灯火焰上灼烧 | 火焰呈黄色 | 溶液中含Na+,无K+ |
| A. | A | B. | B | C. | C | D. | D |
14.下列化学用语表示正确的是( )
| A. | Cl-的结构示意图: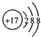 | |
| B. | 聚丙烯的结构简式: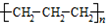 | |
| C. | 三氟化氮的电子式: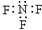 | |
| D. | 熔融硫酸氢钾电离方程式:KHSO4$\frac{\underline{\;熔融\;}}{\;}$ K++H++SO42- |
1.下列依据相关实验得出的结论正确的是( )
| A. | 用激光笔照射淀粉溶液和葡萄糖溶液,能产生光亮的“通路”的是淀粉溶液 | |
| B. | 将某气体通入淀粉碘化钾溶液中,溶液变蓝色,该气体一定是Cl2 | |
| C. | 向某溶液中加入AgNO3溶液,产生白色沉淀,该溶液中一定含Cl- | |
| D. | 向某稀溶液中加入少量NaOH溶液,未产生使湿润的红色石蕊试纸变蓝的气体,该溶液中一定 不含NH4+ |
18.下列属于弱电解质的是( )
| A. | 铜 | B. | 硝酸钾 | C. | 氢氧化钠 | D. | 纯醋酸 |
11.锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
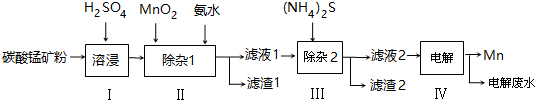
已知25℃,部分物质的溶度积常数如表:
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是:升高温度、适当增大硫酸浓度、减小矿粉颗粒直径.(至少答两条)
(2)则滤渣1的主要成分为Fe(OH)3(填化学式).已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;Fe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+.
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失.
(4)滤液2中,c(Co2+):c(Ni2+)=5:1.
(5)将质量为a kg的碳酸锰矿经上述流程处理后得到单质Mn b kg.若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为$\frac{(b-\frac{c}{107}×\frac{1}{2}×55)×\frac{115}{55}}{a}$×100%.(用含a、b、c的式子表达,无需化简)

已知25℃,部分物质的溶度积常数如表:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)则滤渣1的主要成分为Fe(OH)3(填化学式).已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;Fe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+.
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失.
(4)滤液2中,c(Co2+):c(Ni2+)=5:1.
(5)将质量为a kg的碳酸锰矿经上述流程处理后得到单质Mn b kg.若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为$\frac{(b-\frac{c}{107}×\frac{1}{2}×55)×\frac{115}{55}}{a}$×100%.(用含a、b、c的式子表达,无需化简)