题目内容
2.某学生在配制一定物质的量浓度氢氧化钠时,结果所配溶液浓度偏高,其原因可能是( )| A. | 所用氢氧化钠已经潮解 | |
| B. | 向容量瓶中加水未到刻度线 | |
| C. | 有少量氢氧化钠溶液残留在烧杯里 | |
| D. | 用带游码的托盘天平称2.4 gNaOH时误用了“左码右物”方法 |
分析 根据c=$\frac{n}{V}$,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差.
解答 解:A、所用NaOH已潮解,则所称量的氢氧化钠固体的实际质量偏小,则浓度偏低,故A错误;
B、向容量瓶中加水未到刻度线,则溶液体积偏小,浓度偏高,故B正确;
C、有氢氧化钠溶液残留在烧杯里,会导致溶质的损失,则浓度偏低,故C错误;
D、正确的称量方法为左物右码,如果砝码和游码放反了,会导致所称量的氢氧化钠固体的质量小于2.4g,则所配溶液的浓度偏低,故D错误.
故选B.
点评 本题考查了一定物质的量浓度溶液的配制过程中的误差分析,难度不大,注意实验的基本操作方法和注意事项.

练习册系列答案
相关题目
14.下列实验操作中正确的是( )
| A. | 将溴水、铁粉和苯混合加热即可制得溴苯 | |
| B. | 除去溴苯中红棕色的溴,可用稀NaOH溶液反复洗涤,再用分液漏斗分液 | |
| C. | 用苯和浓HNO3、浓H2SO4反应制取硝基苯时需水浴加热,温度计应放在反应混合液中 | |
| D. | 制取硝基苯时,应先向试管中加入浓H2SO4 2 mL,再加入1.5 mL浓HNO3,再滴入苯约1 mL,然后放在水浴中加热 |
15.向a mol BaCl2、AlCl3和FeCl3的混合液A中,逐滴加入Na2SO4和NaOH的混合液B,产生沉淀的物质的量n与加入溶液B的体积关系如图所示,下列叙述正确的是( )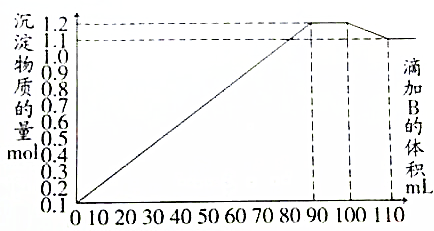

| A. | 加入90mL B时,A溶液中金属离子沉淀完全 | |
| B. | 加入110mL B时,沉淀物仅为BaSO4 | |
| C. | B溶液中Na2SO4和NaOH的物质的量浓度之比为1:1 | |
| D. | 当溶液中含有NaAlO2时,加入溶液B的体积V(B)≥100mL |
10. 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.
(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=l.0.
①从起始经过5min达到化学平衡时,用生成物CO2表示该反应的反应速率v(CO2)=0.01mol/(L.min);平衡时,容器中CO的转化率为50%.
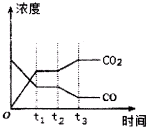
②如图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则t2时刻发生改变的条件可能是降低温度或降低H2浓度或增大H2O(g)浓度.(写出一条)
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+$\frac{1}{2}$O2(g)?CO2(g)降低其浓度.
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请在表中的空格处填写“>““<”或“=“.
②相同温度下,某汽车尾气中CO、CO2的浓度分别为l.0×10-5mol/L和1.0×l0-4mol/L.若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×l0-4mol/L,则最终尾气中CO的浓度为1.1×10-6mol/L(请保留两位有效数字).
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0-4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为5.6×10-5mol/L.
 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=l.0.
| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
②如图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则t2时刻发生改变的条件可能是降低温度或降低H2浓度或增大H2O(g)浓度.(写出一条)
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+$\frac{1}{2}$O2(g)?CO2(g)降低其浓度.
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请在表中的空格处填写“>““<”或“=“.
| 容器编号 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0-4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为5.6×10-5mol/L.
17.化学与社会、生产、生活紧切相关,下列说法正确的是( )
| A. | 信息产业中的光缆的主要成份是单质硅 | |
| B. | NO2、CO2、SO2、PM2.5颗粒都会导致酸雨 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 发酵粉能使焙制出的糕点疏松多孔,是因为发酵粉中含有碳酸氢钠 |
7.标准状况下,将VLH2S气体通入a Lb mo l/L的 NaOH 溶液中,下列对所得溶液的描述不正确的是( )
| A. | 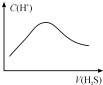 随着 H2S气体的通入,溶液中由水电离出的c(H+)有如图变化关系 | |
| B. | 当$\frac{V}{22.4}$=a b时,所得溶液中存在:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 当$\frac{V}{11.2}$=a b时,所得溶液中存在:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c( H+) | |
| D. | 当$\frac{V}{22.4}$<a b<$\frac{V}{11.2}$时,所得溶液中一定存在:c(Na+)=c(S2-)+c(HS-)+c(H2S) |
11.某非金属元素X的最高化合价为+m,其最高价氧化物的水化物的分子中有b个氧原子,则该元素最高价氧化物的水化物的分子式为( )
| A. | Hm+2bXOb | B. | Hm-2bXOb | C. | Hb+mXOb | D. | H2b-mXOb |
12.去年在西非国家爆发了埃博拉疫情.已知该病情对某些化学药品敏感,乙醇、高锰酸钾溶液、次氯酸钾溶液、双氧水等消毒剂可以完全灭活病毒感染性.下列说法正确的是( )
| A. | 次氯酸的结构式为H-O-Cl | |
| B. | 过氧化氢的电子式为 | |
| C. | 在此氯酸钠溶液中通过少量二氧化硫可得到亚硫酸钠和次氯酸 | |
| D. | 乙醇、高锰酸钾溶液和双氧水均可以将该病毒氧化而达到消毒的目的 |
 (Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等.
(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等. .
.