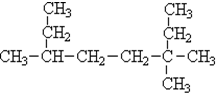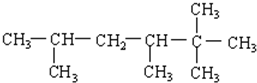题目内容
11.某非金属元素X的最高化合价为+m,其最高价氧化物的水化物的分子中有b个氧原子,则该元素最高价氧化物的水化物的分子式为( )| A. | Hm+2bXOb | B. | Hm-2bXOb | C. | Hb+mXOb | D. | H2b-mXOb |
分析 在化合物中各元素化合价的代数和为0,同一非金属元素的最高化合价与其最低化合价的绝对值之和为8,一般的化合物中H元素显+1价、O元素显-2价,据此判断酸的分子式.
解答 解:某非金属元素X的最高化合价为+m,且其最高价氧化物的水化物的分子中有b个氧原子,其化学式应符合HxXOb,由化合物中化合价代数和为0,得x+m+(-2)×b=0,解得:x=2b-m,最高价氧化物的水化物的分子式为H2b-mXOb,故选D.
点评 本题考查了原子结构和元素性质,明确同一非金属元素其最高正价和最低负价的关系、化合物中化合价的关系即可解答,题目难度不大.

练习册系列答案
相关题目
2.某学生在配制一定物质的量浓度氢氧化钠时,结果所配溶液浓度偏高,其原因可能是( )
| A. | 所用氢氧化钠已经潮解 | |
| B. | 向容量瓶中加水未到刻度线 | |
| C. | 有少量氢氧化钠溶液残留在烧杯里 | |
| D. | 用带游码的托盘天平称2.4 gNaOH时误用了“左码右物”方法 |
6.下表是周期表中的一部分,根据A-N在周期表中的位置,按要求回答下列问题:
(1)表中元素,氧化性最强的单质是F2,还原性最强的单质是Na(用相关的元素符号或分子式表示)
(2)最高价氧化物的水化物酸性最强的是高氯酸,呈两性的是氢氧化铝.(本小题均填物质的名称)
(3)在B、C、D、F、G、H中,原子半径从大到小的顺序为的是Na>Mg>Al>C>N>F.(用元素符号表示).
(4)在D、F、M的离子半径从大到小的顺序为的是Cl->F->Na+.(用离子符号表示).
(5)F的最高价氧化物对应的水化物和H的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-═AlO2-+2H2O.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | M | N |
(2)最高价氧化物的水化物酸性最强的是高氯酸,呈两性的是氢氧化铝.(本小题均填物质的名称)
(3)在B、C、D、F、G、H中,原子半径从大到小的顺序为的是Na>Mg>Al>C>N>F.(用元素符号表示).
(4)在D、F、M的离子半径从大到小的顺序为的是Cl->F->Na+.(用离子符号表示).
(5)F的最高价氧化物对应的水化物和H的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-═AlO2-+2H2O.
16.元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是b.
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为氩,氧化性最弱的简单阳离子是Na+.
(3)已知:
工业制镁时,电解MgCl2而不电解MgO的原因是MgO的熔点高,熔融时消耗更多能量,增加生产成本;
制铝时,电解Al2O3而不电解AlCl3的原因是氯化铝是共价化合物,熔融态氯化铝难导电.
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗)$→_{460℃}^{Cl_{2}}$SiCl4$\stackrel{蒸馏}{→}$SiCl4(纯)$→_{1100℃}^{H_{2}}$Si(纯)
写出SiCl4的结构式: ;
;
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是b.
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4.
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是b.
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为氩,氧化性最弱的简单阳离子是Na+.
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
制铝时,电解Al2O3而不电解AlCl3的原因是氯化铝是共价化合物,熔融态氯化铝难导电.
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗)$→_{460℃}^{Cl_{2}}$SiCl4$\stackrel{蒸馏}{→}$SiCl4(纯)$→_{1100℃}^{H_{2}}$Si(纯)
写出SiCl4的结构式:
 ;
;(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是b.
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4.
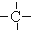
3.烷烃分子可以看作由以下基团组合而成:-CH3、-CH2-、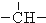 、
、 .如某烷烃分子中同时存在这四种基团,-CH2-、
.如某烷烃分子中同时存在这四种基团,-CH2-、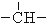 、
、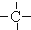 分别为m、n、a个,则该烷烃中-CH3的数目应是( )
分别为m、n、a个,则该烷烃中-CH3的数目应是( )
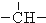 、
、 .如某烷烃分子中同时存在这四种基团,-CH2-、
.如某烷烃分子中同时存在这四种基团,-CH2-、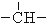 、
、 分别为m、n、a个,则该烷烃中-CH3的数目应是( )
分别为m、n、a个,则该烷烃中-CH3的数目应是( )| A. | 2m+3n+4a | B. | m+2n+2a | C. | n+2a+2 | D. | m+n+2a |
20.下列比较中不正确的是( )
| A. | 离子半径:Cl->F->Na+ | B. | 热稳定性:HCl>H2S>HF | ||
| C. | 酸性:HClO4>H2SO4>H2CO3 | D. | 熔点:金刚石>晶体硅>CO2 |
1.如图为锌铜显示原电池装置图,下列说法不正确( )


| A. | 电子由Zn极流向Cu极 | |
| B. | 该装置的总反应Zn+Cu2+═Zn2++Cu | |
| C. | 一段时间后,A池带正电荷,B池带负电荷 | |
| D. | 取出盐桥,电流计指针不再偏转 |