题目内容
20.下列电离方程式书写正确的是( )| A. | H2SO4=H2++SO42- | B. | NaOH=Na++O2-+H+ | C. | Ba(OH)2=Ba2++OH2- | D. | CaCl2=Ca2++2Cl- |
分析 A.硫酸电离出2个氢离子,2个氢离子不能合并;
B.氢氧化钠电离出钠离子和氢氧根离子,氢氧根离子不能拆开;
C.氢氧化钡电离出钡离子和2个氢氧根离子,氢氧根离子表示错误;
D.氯化钙电离出钙离子和2个氯离子.
解答 解:A.硫酸为强电解质,在溶液中完全电离,其正确的电离方程式为:H2SO4=2H++SO42-,故A错误;
B.NaOH为强电解质,在溶液中完全电离出钠离子和氢氧根离子,正确的电离方程式为:NaOH=Na++OH-,故B错误;
C.氢氧化钡为强电解质,在溶液中完全电离出钡离子和氢氧根离子,其正确的电离方程式为:Ba(OH)2=Ba2++2OH-,故C错误;
D.氯化钙在溶液中完全电离出钙离子和氯离子,其电离方程式为:CaCl2=Ca2++2Cl-,故D正确;
故选D.
点评 本题考查了电离方程式书写方法,题目难度中等,明确电离方程式的书写原则为解答关键,注意掌握判断强电解质、弱电解质的方法,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
10.用苦卤(含Na+、K+、Mg2+、Cl-、Br-等)可提取溴,其生产流程如下:

则下列说法中,错误的是( )

则下列说法中,错误的是( )
| A. | 反应③的离子方程式为5Br-+BrO3-+6H+═3Br2+3H2O | |
| B. | ②③的目的是富集溴,提高Br2的浓度 | |
| C. | 蒸馏塔温度控制在90℃左右的原因是防止温度过高将水蒸馏出来 | |
| D. | 从海水中提取任何化学物质都需要经过化学变化 |
11.下列反应中属于加成反应的是( )
| A. | 乙烯使溴水褪色 | |
| B. | 将苯滴入溴水中,振荡后水层接近无色 | |
| C. | 乙烯使酸性KMnO4溶液褪色 | |
| D. | 甲烷与氯气混合,黄绿色消失 |
15.下列说法正确的是( )
| A. | 在101 k Pa时,1 mol C与适量O2反应生成1mol CO时,放出110.5 kJ热 量,则C的燃烧热为110.5 kJ/mol | |
| B. | 在10l k Pa时l mol H2完全燃烧生成液态水放出285.8 kJ热量,H2燃烧热为-285.8KJ/mol | |
| C. | 鉴定HCl和NaOH反应的中和热时,每次实验均应测量3个温度即盐酸起始温度、NaOH起始温度和反应后终止温度 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ |
5.面粉厂严禁烟火的主要原因( )
| A. | 防止火灾发生 | B. | 防止污染面粉 | ||
| C. | 吸烟有害健康 | D. | 面粉颗粒极易被引燃而发生爆炸 |
12.用一种试剂鉴别乙醇、苯、1-己烯、苯酚溶液,可选用的试剂是( )
| A. | 溴水 | B. | 氯化铁溶液 | C. | 高锰酸钾溶液 | D. | 四氯化碳 |
9.下列说法可以证明反应N2+3H2?2NH3已达到平衡状态的是( )
| A. | 消耗1mol N2的同时,生成2mol NH3 | |
| B. | N2、H2、NH3的反应速率比为1:3:2的状态 | |
| C. | 1mol N≡N键断裂的同时,有6mol N-H 键断裂 | |
| D. | N2和H2浓度相等的时候 |
10.镁电池毒性低、污染小,电压高且平稳,它逐渐成为人们研究绿色电池的关注焦点.其中一种镁电池的反应原理为:xMg+Mo3S4 $?_{充电}^{放电}$MgxMo3S4,下列说法正确的是( )
| A. | 放电时Mo3S4发生氧化反应 | |
| B. | 放电时,正极反应式为:Mo3S4+2xe-=Mo3S42x- | |
| C. | 充电时,电路中通过2mol电子时,可消耗1mol Mg | |
| D. | 充电时,Mg2+向负极移动 |
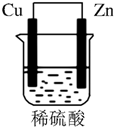 由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空:
由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空: