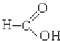
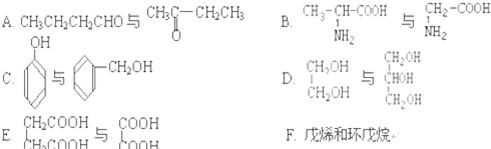题目内容
已知盐酸和镁反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:①蒸馏水②NaCl溶液③NaNO3固体④Na2CO3固体⑤CH3COONa固体,你认为可行的是( )
| A、①②③ | B、①②⑤ | C、④ | D、全部 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:盐酸与过量铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,则减小氢离子浓度,不能改变氢离子的物质的量即可,以此来解答.
解答:
解:①加入蒸馏水,减小氢离子浓度,不能改变氢离子的物质的量,故正确;
②加入NaCl溶液,溶液体积增大,浓度减小,反应速率减小,但生成氢气的总量不变,故正确;
③加入NaNO3固体,在酸性溶液中与Fe发生氧化还原反应生成NO,不生成氢气,故错误;
④加入Na2CO3固体,与盐酸反应,生成氢气的总量减小,故错误;
⑤加CH3COONa固体,与盐酸电离的氢离子结合生成弱电解质,减小氢离子浓度,不能改变氢离子的物质的量,故正确.
故选B.
②加入NaCl溶液,溶液体积增大,浓度减小,反应速率减小,但生成氢气的总量不变,故正确;
③加入NaNO3固体,在酸性溶液中与Fe发生氧化还原反应生成NO,不生成氢气,故错误;
④加入Na2CO3固体,与盐酸反应,生成氢气的总量减小,故错误;
⑤加CH3COONa固体,与盐酸电离的氢离子结合生成弱电解质,减小氢离子浓度,不能改变氢离子的物质的量,故正确.
故选B.
点评:本题考查化学反应速率的影响因素,为高频考点,把握习题中的信息及浓度对反应速率的影响为解答的关键,注重基础知识的考查,加NaNO3固体为解答的易错点,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
关于用CCl4萃取碘水的说法中不正确的是( )
| A、碘在CCl4中的溶解度大于在水中的溶解度 |
| B、萃取后上层颜色变浅 |
| C、萃取后CCl4溶液层为紫红色 |
| D、用酒精也可萃取碘水中的碘 |
对于体积相同的①(NH4)2SO4、②NH4HSO4、③H2SO4溶液,下列说法正确的是( )
| A、溶液的pH相同时,3种溶液物质的量浓度大小顺序是③>②>① |
| B、溶液的pH相同时,将3种溶液稀释相同倍数,pH变化最大的是① |
| C、溶液的pH相同时,由水电离出的c(H+)大小顺序是③>②>① |
| D、若3种溶液的物质的量浓度都相同,则溶液的pH大小顺序是①>②>③ |
在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)═Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表,下列说法正确的是( )
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A、上述生成Ni(CO)4的反应为吸热反应 |
| B、25℃时,反应Ni(CO)4(g)═Ni(s)+4CO(g)的平衡常数为2×10-5 |
| C、80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol?L-1 |
| D、80℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol?L-1,则此时υ(正)>υ(逆) |
制备硅单质时,主要化学反应如下:
①SiO2+2C
Si+2CO↑
②Si+2Cl2
SiCl4
③SiCl4+2H2
Si+4HCl
下列对上述三个反应的叙述中,不正确的是( )
①SiO2+2C
| ||
②Si+2Cl2
| ||
③SiCl4+2H2
| ||
下列对上述三个反应的叙述中,不正确的是( )
| A、①③为置换反应 |
| B、①②③均为氧化还原反应 |
| C、①②③均为非离子反应 |
| D、三个反应中硅元素均被还原 |


 ③
③ ④
④ ⑤
⑤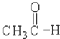 ⑥
⑥