题目内容
5.下列关于Fe及其化合物的性质的相关描述不正确的是( )| A. | 生铁易被腐蚀,纯铁不易被腐蚀 | |
| B. | 常温下可用铁制容器来运输浓硫酸 | |
| C. | Fe2+的检验:取少量样品溶液,加入适量氯水,再滴2滴KSCN溶液,振荡观察 | |
| D. | 工业上常用稀盐酸或稀硫酸除铁锈 |
分析 A.生铁中含有碳,碳、铁和电解质溶液构成原电池;
B.常温下,浓硫酸使铁钝化;
C.亚铁离子被氯气氧化为铁离子,铁离子遇到硫氰化钾显示红色;
D.铁锈能溶于稀盐酸或稀硫酸.
解答 解:A.生铁中含有碳,碳、铁和电解质溶液构成原电池,Fe作负极被腐蚀,所以生铁易被腐蚀,故A正确;
B.常温下,浓硫酸使铁钝化,在Fe的表面生成致密的氧化膜,能保护内部金属,所以常温下可用铁制容器来运输浓硫酸,故B正确;
C.亚铁离子被氯气氧化为铁离子,铁离子遇到硫氰化钾显示红色,不能排除溶液中是否含有铁离子,所以检验亚铁离子应该先加KSCN溶液,若不变红色,在加氯水,故C错误;
D.铁锈的主要成分是氧化铁,氧化铁能溶于稀盐酸或稀硫酸,所以工业上常用稀盐酸或稀硫酸除铁锈,故D正确.
故选C.
点评 本题考查了铁单质及其化合物的性质、属的腐蚀与防护,题目难度不大,主要把握常见元素化合物的性质及其应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列涉及工业生产原理或操作的叙述正确的是( )
| A. | 合成氨生产过程中将NH3液化分离,会降低反应速率,但可提高N2、H2的转化率 | |
| B. | 从海水提取镁的过程中,电解熔融的MgO制备Mg | |
| C. | 合成氨工业温度选择为450℃,主要是为了提高化学反应速率 | |
| D. | 电解饱和食盐水制烧碱时,应在阴极室加入饱和NaCl溶液 |
16.化学与科学、技术、社会、环境密切相关,下列有关说法不正确的是( )
| A. | 含钙、钡、铂等金属的物质有绚丽的颜色,可用于制造焰火 | |
| B. | NO可用于某些疾病的治疗 | |
| C. | 盐碱地(含较多的NaCl、Na2CO3等)中施加适量石膏可降低土壤的碱性 | |
| D. | 雨后彩虹既是一种自然现象,又是一种光学现象,同时也与胶体有关 |
13.已知: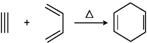 .若要合成
.若要合成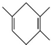 ,则所用的反应物可以是
,则所用的反应物可以是
①2-甲基-1,3-丁二烯和2-丁炔 ②1,3-戊二烯和2-丁炔
③2,3-二甲基-1,3-戊二烯和乙炔 ④2,3-二甲基-1,3-丁二烯和丙炔( )
 .若要合成
.若要合成 ,则所用的反应物可以是
,则所用的反应物可以是①2-甲基-1,3-丁二烯和2-丁炔 ②1,3-戊二烯和2-丁炔
③2,3-二甲基-1,3-戊二烯和乙炔 ④2,3-二甲基-1,3-丁二烯和丙炔( )
| A. | ①④ | B. | ①② | C. | ②④ | D. | ②③ |
20.下列关于胶体的说法正确的是( )
| A. | 向NaOH溶液中逐滴滴入饱和氯化铁溶液来制备Fe(OH)3胶体 | |
| B. | 向Fe(OH)3胶体中逐滴滴入稀盐酸,现象是先出现红褐色沉淀,后溶解转为黄色溶液 | |
| C. | “丁达尔”效应是区分胶体和溶液的唯一手段 | |
| D. | 静电除尘与胶体性质无关 |
10.25℃下,0.1mol/L的Na2S溶液,下列叙述正确的是( )
| A. | 升高温度,溶液的pH降低 | |
| B. | 加入NaOH固体,溶液中的c(Na+)、c(S2--)均增大 | |
| C. | c(Na+)>c(OH-)>c(S2--)>c(H+) | |
| D. | 2c(Na+)=c(S2--)+c(HS-)+c(H2S) |
17.在密闭容器中进行反应:X(g)+3Y(g)?2Z(g),有关下列图象的说法不正确的是( )


| A. | 依据图甲可判断正反应为放热反应 | |
| B. | 在图乙中,虚线可表示使用了催化剂 | |
| C. | 若正反应的△H<0,图丙可表示升高温度使平衡向逆反应方向移动 | |
| D. | 由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
15.下列关于铝及其化合物的叙述正确的是( )
| A. | 铝罐可久盛食醋 | |
| B. | 铝与Fe2O3发生铝热反应,反应后固体物质增重 | |
| C. | 氢氧化铝可作胃酸的中和剂 | |
| D. | 明矾用作净水剂不涉及化学变化 |
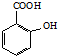 )反应能得到化学式为C7H5O3Na的是A
)反应能得到化学式为C7H5O3Na的是A