题目内容
下列各组物质中,互为同素异形体的是( )
| A、石墨和金刚石 | ||||
| B、甲烷和乙烷 | ||||
C、
| ||||
| D、K和K+ |
考点:同素异形体
专题:原子组成与结构专题
分析:根据同素异形体是同种元素形成的不同单质,同素异形体首先是单质,其次是同种元素,利用该知识分析判断.
解答:
解:A.石墨和金刚石都是由碳元素组成的不同单质,属于同素异形体,故A正确;
B.甲烷和乙烷都是化合物,不属于同素异形体,同属于烷烃重的同系物,故B错误;
C.
H和
H都是原子,不是单质,不属于同素异形体,是氢元素的同位素,故C错误;
D.K为元素或原子或钾单质,K+,为钾原子失去1个电子形成的阳离子,不是单质,所以它们不属于同素异形体,故D错误;
故选A.
B.甲烷和乙烷都是化合物,不属于同素异形体,同属于烷烃重的同系物,故B错误;
C.
1 1 |
2 1 |
D.K为元素或原子或钾单质,K+,为钾原子失去1个电子形成的阳离子,不是单质,所以它们不属于同素异形体,故D错误;
故选A.
点评:本题考查同素异形体的判断,判断是否互为同素异形体的关键要把握两点:①同种元素形成,②不同单质,这是解决此类题的关键之所在.题目难度不大.

练习册系列答案
相关题目
下列各组离子在指定条件下一定不能大量共存的是( )
| A、能使红色石蕊试纸变蓝的溶液中:Na+、K+、CO32-、NO3-、AlO2- |
| B、c(H+)=0.lmol?L-1的溶液中:Cu2+、A13+、SO42-、NO3- |
| C、在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
| D、在含有大量 Fe3+的溶液中:NH4+、Na+、Cl-、SO42- |
下列关于平衡常数K的说法中,正确的是( )
①平衡常数K只与反应本身及温度有关
②改变反应物浓度或生成物浓度都会改变平衡常数K
③加入催化剂不改变平衡常数K
④平衡常数K只与温度有关,与反应的本身及浓度、压强无关.
①平衡常数K只与反应本身及温度有关
②改变反应物浓度或生成物浓度都会改变平衡常数K
③加入催化剂不改变平衡常数K
④平衡常数K只与温度有关,与反应的本身及浓度、压强无关.
| A、①② | B、②③ | C、③④ | D、①③ |
下列物质中属于非电解质的是( )
| A、盐酸 |
| B、氨水 |
| C、H2SO4 |
| D、SO3 |
下列说法正确的是( )
| A、分子晶体中一定不含离子键,但一定存在共价键 |
| B、熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 |
| C、NCl3分子中所有的原子均为8电子稳定结构 |
| D、NaHSO4晶体中阴、阳离子的个数比是1:2,且熔化时破坏的是离子键和共价键 |
下列溶液中的物质的量浓度为1mol/L的是( )
| A、将22.4 L氯化氢气体溶于水配成1 L溶液 |
| B、将40 g NaOH溶于1L水中配成溶液 |
| C、从1 L 1 mol/L的NaOH溶液中取出50 mL,则取出的溶液中溶质的物质的量浓度 |
| D、将1 L 10 mol/L的浓盐酸与9 L水混合 |
氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:
Na3N+H2O→NaOH+NH3
NaH+H2O→NaOH+H2
有关它们的叙述正确的是( )
Na3N+H2O→NaOH+NH3
NaH+H2O→NaOH+H2
有关它们的叙述正确的是( )
| A、离子半径:N3->Na+>H+ |
| B、与水反应都是氧化还原反应 |
| C、与盐酸反应都只生成一种盐 |
| D、两种化合物中的阴阳离子均具有相同的电子层结构 |
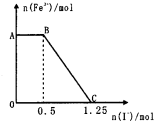 已知酸性高锰酸钾溶液可以将FeS04氧化,方程式为2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是( )
已知酸性高锰酸钾溶液可以将FeS04氧化,方程式为2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是( )| A、图中AB段主要是高锰酸钾和碘化钾溶液反应 |
| B、图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 |
| C、向C点以后的溶液中加入少量KSCN溶液,溶液变红色 |
| D、根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol |
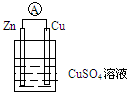 根据如图装置回答:
根据如图装置回答: