题目内容
32g铜跟适量的浓硝酸反应,铜全部作用后,共收集到NO、NO2混合气体22.4L(标准状况下),则反应消耗的硝酸的物质的量是
A.1.0 mol B.1.5 mol C.2.0 mol D.2.5 mol
C
【解析】
试题分析:根据元素守恒,反应后硝酸一部分被还原为气体,一部分生成了硝酸铜,生成硝酸铜的硝酸为32g÷64g/mol×2=1mol,被还原的硝酸为22.4L/22.4L/mol=1mol,共消耗硝酸2mol,答案选C。
考点:氧化还原反应的计算

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案(10分).苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:
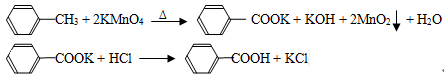
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
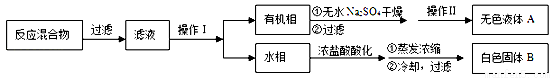
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在答题卡上完成表中内容。
序号 | 实验方案 | 实验现象 | 结论 |
① | 将白色固体B加入水中,加热溶 解, | 得到白色晶体和无色溶液 | ----------------- |
② | 取少量滤液于试管中, | 生成白色沉淀 | 滤液含Cl— |
③ | 干燥白色晶体, | 熔点为122.4℃ | 白色晶体是苯甲酸 |
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10—3mol,产品中苯甲酸质量分数为 (保留二位有效数字)。
 的一元取代产物有
的一元取代产物有
 2SO3(g) △H<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中正确的是
2SO3(g) △H<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中正确的是