题目内容
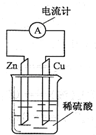
如图所示的原电池装置中,锌为 极,电极发生的是 反应(填氧化或还原),电极反应式为 ;铜电极反应式为 ,铜片上观察到的现象为 。

【答案】
(5分) 负 氧化 Zn-2e-=Zn2+ 2H++2e-=H2↑ 铜片表面有气泡出现
【解析】
试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据装置图可知,锌的金属性强于铜,所以锌是负极,失去电子,发生氧化反应,电极反应式是Zn-2e-=Zn2+;铜是正极,溶液中的氢离子在正极得到电子,发生还原反应,电极反应式是2H++2e-=H2↑,所以铜片上观察到的现象为铜片表面有气泡出现。
考点:考查原电池原理的应用和有关判断
点评:该题是基础性试题的考查,难度不大。明确原电池的工作原理,是答题的关键,有利于调动学生的学习兴趣,激发学生的学习积极性。

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
 如图所示的原电池装置,下列说法不正确的是( )
如图所示的原电池装置,下列说法不正确的是( ) (2012?吉林一模)实验发现,298K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+.某化学兴趣小组根据该实验事实设计了如图所示的原电池装置.下列有关说法中正确的是( )
(2012?吉林一模)实验发现,298K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+.某化学兴趣小组根据该实验事实设计了如图所示的原电池装置.下列有关说法中正确的是( ) 如图所示的原电池装置,X、Y为两个电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列叙述正确的是( )
如图所示的原电池装置,X、Y为两个电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列叙述正确的是( ) 能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.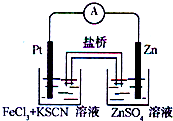 实验发现,在FeCl3酸性溶液中加入少量锌粉后,Fe3+立即被还原成Fe2+.某化学兴趣小组根据该实验事实设计了如图所示的原电池装置.下列有关说法中正确的是( )
实验发现,在FeCl3酸性溶液中加入少量锌粉后,Fe3+立即被还原成Fe2+.某化学兴趣小组根据该实验事实设计了如图所示的原电池装置.下列有关说法中正确的是( )