题目内容
 联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP 二氧化碳排放比2005年下降40%-45%.
联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP 二氧化碳排放比2005年下降40%-45%.(1)有效“减碳”的手段之一是节能.下列制氢方法最节能的是
A.电解水制氢:2H2O
| ||
B.高温使水分解制氢:2H2O
| ||
C.太阳光催化分解水制氢:2H2O
| ||
| 太阳光 |
D.天然气制氢:CH4+H2O
| 高温 |
(2)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一.
2CO2(g)=6H2(g)→CH3OCH3(g)=3H20(g)△H>0.
请在坐标图中用虚线画出上述反应在有催化剂情况下反应 过程中体系能量变化示意图.
(3)C02可转化成有机物实现碳循环.在某温度下体积为1L的恒容密闭容器中,充入 1molC02和3mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测 得CO2和CH3OH(g)的浓度随时间变化如图所示.

①从3min 到 10min,v(H2)=
②能说明上述反应达到平衡状态的是
A.反应中C02与CH30H的物质的量浓度之比为1:1
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n(CH3OH)/n(CO2)增大的是
A.升高温度B.恒温恒容充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入1mol CO2和3mol H2
④计算该温度下此反应的平衡常数K=
A增大压强 B增大反应物浓度 C降低温度 D升高温度E加入催化剂.
考点:物质的量或浓度随时间的变化曲线,化学平衡常数的含义,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)有效“减碳”的手段之一是节能,利用太阳光催化分解水制氢是最节能的,减少电能、天然气、热能的利用;
(2)化剂不影响反应热,但催化剂降低反应所需的活化能,以此来图画;
(3)①根据v=
计算出v(CH3OH),然后根据速率之比等于化学计量数之比求出v(H2);
②在一定条件下,当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理性也不变;
③依据化学平衡移动原理结合反应特征防止判断选项;
④依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到,改变条件使K=1.
(2)化剂不影响反应热,但催化剂降低反应所需的活化能,以此来图画;
(3)①根据v=
| △c |
| △t |
②在一定条件下,当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理性也不变;
③依据化学平衡移动原理结合反应特征防止判断选项;
④依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到,改变条件使K=1.
解答:
解:(1)A、消耗电能,不是最节能的方法,故A错误;
B、消耗热能,不是减碳的手段,故B错误;
C、利用太阳光催化分解水制氢是最节能的,故C正确;
D、天然气是非再生能源,且不是最节能的方法,故D错误;
故答案为:C;
(2)催化剂不影响反应热,但催化剂降低反应所需的活化能,如图所示催化剂对反应的影响为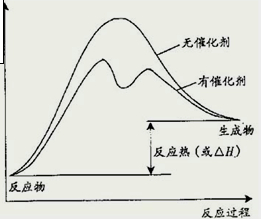 ,
,
故答案为: ;
;
(3)①由图象可知:v(CH3OH)=
=0.0357mol/(L?min),v(H2)=3v(CH3OH)=0.11mol/(L?min);
故答案为:0.11mol/(L?min);
②A.由图可知反应中CO2与CH3OH的物质的量浓度之比为1:1时,并未达到平衡状态,故A错误;
B.因气体的质量不变,容器的体积不变,则无论是否达到平衡状态,都存在混合气体的密度不随时间的变化而变化,不能判断是否达到平衡状态,故B错误;
C.无论是否达到平衡状态,都存在单位时间内每消耗3molH2,同时生成1molH2O,故C错误;
D.CO2的体积分数在混合气体中保持不变,说明达到平衡状态,故D正确;
故选:D;
③CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,反应是气体体积减小的放热反应,能使
增大,说明平衡正向进行;
A.反应是吸热反应,升高温度,平衡逆向进行,
减小,故A不符合;
B.恒温恒容充入He(g),总压增大,分压不变,平衡不动,故
不变,故B不符合;
C.将H2O(g)从体系中分离,平衡正向进行,
增大,故C符合;
D.恒温恒容再充入1mol CO2和3mol H2 ,相当于增大压强,平衡正向进行,
增大,故D符合;
故答案为:CD.
④依据化学平衡三段式列式计算,在某温度下体积为1L的恒容密闭容器中,充入 1molC02和3mol H2,图象分析平衡使甲醇浓度为0.75mol/L,二氧化碳浓度为0.25mol/L,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L)0.25 0.75 0.75 0.75
平衡常数K=
=
;
改变条件使K=1,应使平衡逆向进行,分析选项改变条件
A、增大压强,平衡正向进行,平衡常数不变,故A不符合;
B、增大反应物浓度,平衡正向进行,平衡常数不变,故B不符合;
C、反应是放热反应,降低温度,平衡正向进行,平衡常数增大,故C不符合;
D、升高温度,平衡逆向进行,平衡常数减小,可以达到K=1,故D符合;
E、加入催化剂,改变反应速率不改变化学平衡,平衡不动,平衡常数不变,故E不符合;
故答案为:
;D.
B、消耗热能,不是减碳的手段,故B错误;
C、利用太阳光催化分解水制氢是最节能的,故C正确;
D、天然气是非再生能源,且不是最节能的方法,故D错误;
故答案为:C;
(2)催化剂不影响反应热,但催化剂降低反应所需的活化能,如图所示催化剂对反应的影响为
 ,
,故答案为:
 ;
;(3)①由图象可知:v(CH3OH)=
| 0.75mol/L-0.5mol/L |
| 7min |
故答案为:0.11mol/(L?min);
②A.由图可知反应中CO2与CH3OH的物质的量浓度之比为1:1时,并未达到平衡状态,故A错误;
B.因气体的质量不变,容器的体积不变,则无论是否达到平衡状态,都存在混合气体的密度不随时间的变化而变化,不能判断是否达到平衡状态,故B错误;
C.无论是否达到平衡状态,都存在单位时间内每消耗3molH2,同时生成1molH2O,故C错误;
D.CO2的体积分数在混合气体中保持不变,说明达到平衡状态,故D正确;
故选:D;
③CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,反应是气体体积减小的放热反应,能使
| n(CH3OH) |
| n(CO2) |
A.反应是吸热反应,升高温度,平衡逆向进行,
| n(CH3OH) |
| n(CO2) |
B.恒温恒容充入He(g),总压增大,分压不变,平衡不动,故
| n(CH3OH) |
| n(CO2) |
C.将H2O(g)从体系中分离,平衡正向进行,
| n(CH3OH) |
| n(CO2) |
D.恒温恒容再充入1mol CO2和3mol H2 ,相当于增大压强,平衡正向进行,
| n(CH3OH) |
| n(CO2) |
故答案为:CD.
④依据化学平衡三段式列式计算,在某温度下体积为1L的恒容密闭容器中,充入 1molC02和3mol H2,图象分析平衡使甲醇浓度为0.75mol/L,二氧化碳浓度为0.25mol/L,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L)0.25 0.75 0.75 0.75
平衡常数K=
| 0.75×0.75 |
| 0.25×0.753 |
| 16 |
| 3 |
改变条件使K=1,应使平衡逆向进行,分析选项改变条件
A、增大压强,平衡正向进行,平衡常数不变,故A不符合;
B、增大反应物浓度,平衡正向进行,平衡常数不变,故B不符合;
C、反应是放热反应,降低温度,平衡正向进行,平衡常数增大,故C不符合;
D、升高温度,平衡逆向进行,平衡常数减小,可以达到K=1,故D符合;
E、加入催化剂,改变反应速率不改变化学平衡,平衡不动,平衡常数不变,故E不符合;
故答案为:
| 16 |
| 3 |
点评:本题考查了化学平衡影响因素、平衡标志判断、平衡常数计算等分析,主要是化学平衡移动原理的理解应用,平衡常数随温度变化,不随浓度,压强等改变,题目难度中等.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
工业上利用天然气(CH4)与CO2气体在高温下重整制备CO气体,反应的化学方程式是CH4+CO2
2CO+2H2,下列有关说法正确的是( )
| ||
| A、CH4是还原剂,CO2是氧化剂 |
| B、1mol CO2完全反应需转移2mol电子 |
| C、CO既是氧化产物又是还原产物 |
| D、氧化产物和还原产物的物质的量之比为1:1 |
下列反应中,水只作还原剂的是( )
| A、CaO+H2O═Ca(OH)2 |
| B、C+H2O═CO+H2 |
| C、2F2+2H2O═4HF+O2 |
| D、3NO2+H2O═2HNO3+NO |
下列关于金属钠的叙述中正确的是( )
| A、钠可以保存在煤油或四氯化碳中 |
| B、钠露置在空气中表面生成淡黄色的Na2O |
| C、钠在空气中燃烧,生成白色的Na2O2 |
| D、钠与水反应的实验可以说明钠硬度小、熔点低、密度大于水 |
下表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | 1.8×10-5 | 3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A、相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
| B、NaClO溶液中通入少量CO2气体的离子方程式:2ClO-+CO2+H2O=CO32-+2HClO |
| C、向0.1mol?L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5 |
| D、相同物质的量浓度的下列溶液,pH的大小关系是Na2CO3>NaHCO3>NaClO>CH3COONa |

