题目内容
 如图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:
如图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:(1)a为电源的
(2)写出电极反应方程式:A
(3)A电极析出气体体积为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)B电极质量增加依据电解池原理分析判断,B为电解池的阴极,A为阳极,a为电源正极,b为电源负极;
(2)电解过程中阳极电极反应4OH--4e-=2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu;
(3)根据两极上转移的电子相等,结合电极反应式计算.
(2)电解过程中阳极电极反应4OH--4e-=2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu;
(3)根据两极上转移的电子相等,结合电极反应式计算.
解答:
解:B电极质量增加依据电解池原理分析判断,B为电解池的阴极,A为阳极,a为电源正极,b为电源负极;电解过程中阳极电极反应4OH--4e-=2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu;
(1)a电极是电源的正极,b为电源负极;
故答案为:正;负;
(2)依据分析可知A为阳极,溶液中氢氧根离子失电子生成氧气,电极反应为:4OH--4e-=2H2O+O2↑,B为阴极,溶液中铜离子得到电子生成铜,
电极反应为:Cu2++2e-=Cu,
故答案为:4OH--4e-=2H2O+O2↑;Cu2++2e-=Cu;
(3)将B电极取出洗干净并干燥后称量其质量增加了3.2g,则析出铜物质的量=
=0.05mol,根据Cu2++2e-=Cu,可知转移的电子为0.1mol;已知4OH--4e-=2H2O+O2↑,根据转移的电子守恒得,生成氧气为n(O2)=
×0.1mol=0.025mol,所以V(O2)=22.4L/mol×0.025mol=0.56L,
故答案为:0.56.
(1)a电极是电源的正极,b为电源负极;
故答案为:正;负;
(2)依据分析可知A为阳极,溶液中氢氧根离子失电子生成氧气,电极反应为:4OH--4e-=2H2O+O2↑,B为阴极,溶液中铜离子得到电子生成铜,
电极反应为:Cu2++2e-=Cu,
故答案为:4OH--4e-=2H2O+O2↑;Cu2++2e-=Cu;
(3)将B电极取出洗干净并干燥后称量其质量增加了3.2g,则析出铜物质的量=
| 3.2g |
| 64g/mol |
| 1 |
| 4 |
故答案为:0.56.
点评:本题考查了电解池原理的分析应用,明确电极判断和电极反应的书写方法,及电子转移守恒计算应用是解题关键,题目难度中等.

练习册系列答案
相关题目
关于反应2K+2H2O=2KOH+H2↑的有关叙述中,正确的是( )
| A、K被氧化 |
| B、H2O被氧化 |
| C、KOH是还原产物 |
| D、H2是氧化产物 |
下列各组物质的性质排序正确的是( )
| A、酸性:H3PO4>H2SO4>HClO4 |
| B、水溶性:NH3>CO2>SO2>H2S |
| C、热稳定性:HF>H2O>NH3 |
| D、沸点:新戊烷>正戊烷>丁烷 |
下列说法正确的是( )
| A、在氧化还原反应中,金属单质只体现还原性,金属阳离子只体现氧化性 |
| B、能在水溶液或熔融状态下导电的物质是电解质 |
| C、清晨的阳光穿过茂密的树木枝叶所产生的美丽景象(美丽的光线)是由于胶体粒子对光线的散射形成的 |
| D、在一个氧化还原反应中,有一种素被氧化,必有另一种元素被还原 |
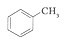 和
和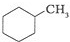 .其中互为同分异构体的是
.其中互为同分异构体的是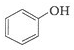 )、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH).
)、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH).