题目内容
现有等物质的量的NaHCO3和KHCO3的混合物m克与100mL盐酸反应.(题中涉及的气体体积均以标准状况计,填空时可以用带字母的分式表示)
(1)该混合物中NaHCO3与KHCO3的质量比为______
(2)若碳酸氢盐与盐酸恰好完全反应,则盐酸的浓度为______mol/L
(3)若NaHCO3和KHCO3不是以等物质的量混合,则m克固体混合物与足量的盐酸完全反应时生成CO2的体积范围是______.
则m(NaHCO3):m(KHCO3)=84ng:100ng=21:25,
故答案为:21:25:
(2)混合物的平均摩尔质量为:M=
 =92g/mol,
=92g/mol,所以n(碳酸氢盐)=
 =
= mol,
mol,HCO3-+H+=CO2↑+H2O
1 1
 mol n(H+)
mol n(H+)n(H+)=
 mol,
mol,c(HCl)=
 =
= mol/L,
mol/L,故答案为:
 ;
;(3)假设全部为NaHCO3,则n(NaHCO3)=
 =
= mol,
mol,HCO3-+H+=CO2↑+H2O
1mol 22.4L
 mol V(CO2)
mol V(CO2)V(CO2)=
 =
= L,
L,假设全部为KHCO3,则n(KHCO3)=
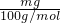 =
= mol,
mol,HCO3-+H+=CO2↑+H2O
1mol 22.4L
 mol V(CO2)
mol V(CO2)V(CO2)=
 =
= L,
L,所以:m克固体混合物与足量的盐酸完全反应时生成CO2的体积范围是:
 L<V(CO2)<
L<V(CO2)< L,
L,故答案为:
 L<V(CO2)<
L<V(CO2)< L.
L.分析:(1)根据m=nM计算质量,进而计算质量比;
(2)计算出NaHCO3和KHCO3的物质的量,根据反应HCO3-+H+=CO2↑+H2O计算盐酸的物质的量,进而计算物质的量浓度;
(3)用端值法计算,假设物质全部为NaHCO3或KHCO3.
点评:本题考查混合物的计算,题目难度中等,本题注意平均摩尔质量的利用,本题中(3)为易错点,注意用端值法解答.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(8分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
阴离子 | OH―、C1―、CO32-、NO3―、SO42- |
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(2)写出E溶液与过量的B溶液反应的离子方程式 。
(3)已知:NaOH(aq)+HNO3(aq)= NaNO3(aq)+H2O(1);△H=-a KJ?mol-1。请写出B与C的稀溶液反应的热化学方程式 。
(4)在100mL0.1mol?L-1E溶液中,逐滴加入35mL 2mol?L-1NaOH溶液,最终得到沉淀物质的量为 。
现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH—、C1—、CO32-、NO3—、SO42- |
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(2)写出E溶液与过量的B溶液反应的离子方程式 。
(3)已知:NaOH(aq)+HNO3(aq)= NaNO3(aq)+H2O(1);△H=-a KJ·mol-1。请写出B与C的稀溶液反应的热化学方程式 。
(4)在100mL0.1mol·L-1E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为 。
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀.
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:______.
(2)写出E溶液与过量的B溶液反应的离子方程式:______.
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(l);△H=-a KJ?mol-1.
请写出B与C的稀溶液反应的热化学方程式______.
(4)在100mL 0.1mol?L-1E溶液中,逐滴加入35mL 2mol?L-1NaOH溶液,最终得到沉淀物质的量为______.
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀.
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:______.
(2)写出E溶液与过量的B溶液反应的离子方程式:______.
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(l);△H=-a KJ?mol-1.
请写出B与C的稀溶液反应的热化学方程式______.
(4)在100mL 0.1mol?L-1E溶液中,逐滴加入35mL 2mol?L-1NaOH溶液,最终得到沉淀物质的量为______.
现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH—、C1—、CO32-、NO3—、SO42- |
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(2)写出E溶液与过量的B溶液反应的离子方程式 。
(3)已知:NaOH(aq)+HNO3(aq)= NaNO3(aq)+H2O(1);△H=-a KJ·mol-1。请写出B与C的稀溶液反应的热化学方程式 。
(4)在100mL0.1mol·L-1E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为 。