题目内容
16.将下列现象或用途中硫酸所表现出来的性质填写在空白处.(1)把锌粒放入稀硫酸中时,有气体放出,酸的氧化性和酸性.
(2)浓硫酸能够用于干燥某些气体,吸水性.
(3)用玻璃棒蘸浓硫酸滴在纸上时,纸变黑,脱水性.
(4)把木炭放入热的浓硫酸中时,有气体放出,强氧化性.
分析 (1)Zn+H2SO4=ZnSO4+H2↑,该反应中H元素化合价由+1价变为0价、Zn元素化合价由0价变为+2价,根据化合价变化判断;
(2)浓硫酸具有吸水性;
(3)浓硫酸具有脱水性;
(4)浓硫酸和碳反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,C元素化合价由0价变为+4价、S元素化合价由+6价变为+4价,根据元素化合价变化确定.
解答 解:(1)Zn+H2SO4=ZnSO4+H2↑,该反应中H元素化合价由+1价变为0价、Zn元素化合价由0价变为+2价,反应生成硫酸锌和氢气,反应生成硫酸盐,体现其酸性,且H元素的化合价降低,体现其弱氧化性,故答案为:酸的氧化性和酸性;
(2)浓硫酸能够用于干燥某些气体,是因浓硫酸具有吸水性,故答案为:吸水性;
(3)用玻璃棒蘸浓硫酸滴在纸上时,纸发黑,是因浓硫酸具有脱水性,使纸中H、O元素以水的形式脱出,留下C元素,故答案为:脱水性;
(4)浓硫酸和碳反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,C元素化合价由0价变为+4价、S元素化合价由+6价变为+4价,该反应中浓硫酸体现强氧化性,故答案为:强氧化性.
点评 本题考查了浓硫酸的性质,知道浓硫酸的三大特性是解本题关键,知道吸水性和脱水性的区别,注意浓硫酸和稀硫酸性质不同点,题目难度不大.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
1.下列实验现象中,由于发生取代反应而引起的是( )
| A. | 乙烯通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色 | |
| B. | 苯在一定温度、压强和催化剂作用下和氢气反应生成环己烷 | |
| C. | 甲烷和氯气的混合气体在光照后,集气瓶内壁上有油状液滴附着 | |
| D. | 将灼热的铜丝迅速插入乙醇中,反复多次,有刺激性气味产生 |
7.下列离子方程式正确的是( )
| A. | 氯气溶于水形成氯水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 将FeO溶解于足量稀HNO3中:FeO+2H+═Fe2++H2O | |
| C. | 硫酸铝溶液中滴加过量浓氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | SO2用过量NaOH溶液吸收:SO2+2OH-═SO32-+H2O |
4.下列叙述正确的是( )
| A. | 室温时,非金属元素的单质都是气体 | |
| B. | 同一周期中,碱金属的第一电离能最小 | |
| C. | VIA 族元素的原子,其半径越大,越容易得到电子 | |
| D. | 同周期元素中,VIIA 族元素的原子半径最大 |
11.下列叙述正确的是( )
| A. | Li在氧气中燃烧能生成Li2O2 | |
| B. | 将SO2通入过量FeCl3和BaCl2的混合溶液中可生成BaSO4沉淀 | |
| C. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后最终溶液呈红色 | |
| D. | 将稀硫酸滴加到Fe(NO3)2溶液中无明显现象 |
8.下列实验装置叙述正确的是( )
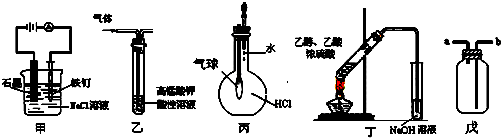
①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的SO2
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2或CO2气体.

①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的SO2
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2或CO2气体.
| A. | ①③⑤ | B. | ③⑤ | C. | ①②④ | D. | ③④ |
5.关于下列图象的说法正确的是( )[注:E-能量,p-压强,t-时间,V-体积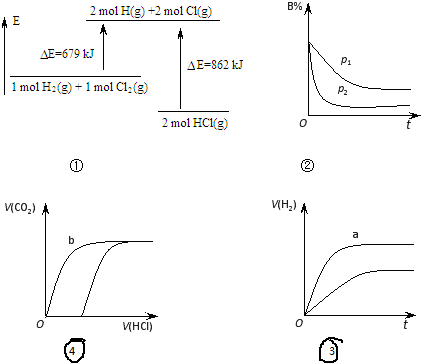

| A. | ①表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=183 kJ/mol | |
| B. | ②表示其它条件不变时,反应 4A(g)+3B(g)?2C(g)+6D在不同压强下 B的体积分数随时间的变化,则D一定是气体 | |
| C. | ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a曲线表示CH3COOH溶液 | |
| D. | ④表示分别向同为10 mL 0.1mol/L Na2CO3和NaHCO3两种溶液中,逐滴滴加0.1mol/L 盐酸,所产生CO2的体积随盐酸体积的变化情况,则b曲线表示Na2CO3溶液 |
 .
. )脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯稳定(填稳定或不稳定).
)脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯稳定(填稳定或不稳定).