题目内容
16.通常状况下,1L由某烷烃A与某不饱和链烃B组成的混合气体完全燃烧生成3.6L CO2,且烃A中所含碳原子数大于烃B中所含碳原子数.1mol该混合气体能与0.4mol Br2恰好完全加成.试通过计算确定A和B可能的结构简式.分析 根据体积之比等于物质的量之比,由混合气体1L充分燃烧后得到同温同压下3.6LCO2,可知混合气体的平均分子式为C3.6Hx,然后根据要想碳原子的平均值为3.6,必须有一种烃的碳原子数小于3.6,另一种烃的碳原子数大于3.6,且碳原子数若>4,那么常温下不是气体,故一种烃中最多为4个碳,据此讨论即可;如果是炔烃与溴水加成,炔应为0.2mol,因此炔烃与溴的物质的量之比为1:2,如果是烯烃与溴水加成,烯烃与溴的物质的量之比为1:1.
解答 解:因1升混合气体充分燃烧后生成3.6升CO2,且A分子的碳原子数比B分子的多,混合气体只能由碳原子数大于3.6的烷烃(C4H10)和碳原子数小于3.6的烯烃或炔烃(C3H6和C2H4、C3H4和C2H2)组成.它们有四种可能的组合:C4H10、C3H6;C4H10、C2H4;C4H10、C3H4;C4H10、C2H2;根据每一种组合中烷烃和烯烃的碳原子数及燃烧后生成的CO2体积,可确定A和B的体积比.如: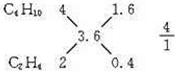 ,则V(C4H10):V(C2H4)=4:1,依此类推,①C4H10、C3H6、3:2;②C4H10、C2H4、4:1③C4H10、C2H2、4:1④C4H10、C3H4、3:2;1mol该混合气体能与0.4mol Br2恰好完全加成,如果是炔烃与溴水加成,炔应为0.2mol,因此炔烃与溴的物质的量之比为1:2,如果是烯烃与溴水加成,即烯烃应为0.4mol,烯烃与溴水物质的量之比为1:1,
,则V(C4H10):V(C2H4)=4:1,依此类推,①C4H10、C3H6、3:2;②C4H10、C2H4、4:1③C4H10、C2H2、4:1④C4H10、C3H4、3:2;1mol该混合气体能与0.4mol Br2恰好完全加成,如果是炔烃与溴水加成,炔应为0.2mol,因此炔烃与溴的物质的量之比为1:2,如果是烯烃与溴水加成,即烯烃应为0.4mol,烯烃与溴水物质的量之比为1:1,
答:A和B可能的结构简式:A:C4H10;B:C2H2;或A:C4H10;B:C3H6.
点评 本题考查有机物分子式的确定,主要考查了十字交叉法、差量法的使用,注意根据燃烧的方程式进行判断,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.常温下,电解质溶液中的下列关系式不正确的是( )
| A. | 已知A-+H2B(过量)═HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 在0.1 mol?L-1的氨水中滴加0.1 mol?L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=10-a mol?L-1 | |
| C. | 将c mol?L-1的醋酸溶液与0.02 mol?L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=$\frac{{2×1{0^{-9}}}}{c-0.02}$ | |
| D. | 将0.2 mol•L-1盐酸与0.1 mol•L-1的KAlO2溶液等体积混合,溶液中离子浓度由大到小的顺序: c(Cl-)>c(K+)>c(Al3+)>c(H+)>c(OH-) |
15.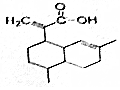 有机物X可作为合成青蒿素的一种基本原料,已知X的结构如图,下列有关X的说法正确的是( )
有机物X可作为合成青蒿素的一种基本原料,已知X的结构如图,下列有关X的说法正确的是( )
 有机物X可作为合成青蒿素的一种基本原料,已知X的结构如图,下列有关X的说法正确的是( )
有机物X可作为合成青蒿素的一种基本原料,已知X的结构如图,下列有关X的说法正确的是( )| A. | X为烃的含氧衍生物 | |
| B. | 1molX最多可以和3mol H2发生加成反应 | |
| C. | X只能发生取代反应和加成反应 | |
| D. | X可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且褪色原理相同 |
4.下列有关实验的说法正确的是( )
| A. | 用湿润的pH试纸测稀盐酸的pH | |
| B. | 用酸式滴定管量取20.00 mL酸性K2Cr2O7溶液 | |
| C. | 用托盘天平称取5.85 gNaCl晶钵 | |
| D. | 用带磨口玻璃塞的试剂瓶保存Na2CO3溶液 |
11.一种气态烷烃和一种气态烯烃组成的混合物共11.6g,混合气体的密度是相同状况下H2密度的14.5倍,该混合气体通过Br2水时,Br2水的质量增加8.4g,则组成该混合气体的可能是( )
| A. | 甲烷、乙烯 | B. | 乙烷、乙烯 | C. | 乙烷、丙烯 | D. | 甲烷、丙烯 |
6.设NA为阿伏加德罗常数,以下叙述正确的是( )
| A. | 1 L 0.1 mol/L NH4NO3溶液中含有铵根离子数目为0.1NA | |
| B. | 标准状况下,22.4 L SO3中含有的氧原子数为3NA | |
| C. | 标准状况下,22.4L氯气与含有1 mol FeI2的溶液反应时,转移的电子数为2NA | |
| D. | 常温常压下,16g O2作氧化剂时转移电子数一定为2NA |
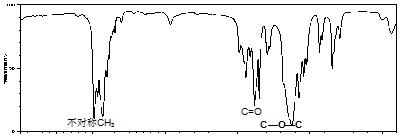
 .
. .
.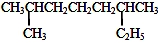 的系统命名是2,6-二甲基辛烷.
的系统命名是2,6-二甲基辛烷.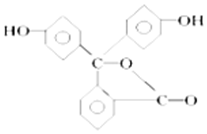
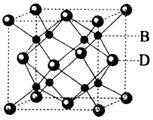 有A、B、C、D、E五种元素,其中A元素的一种核素没有中子,B元素的电负性最大,C元素的基态原子L层上有三个未成对电子,D元素为主族元素且与E元素同周期,其最外电子层上只有两个运动状态不同的电子,E元素有两种常见氧化物E2O、EO,其中E2O为砖红色.请回答:
有A、B、C、D、E五种元素,其中A元素的一种核素没有中子,B元素的电负性最大,C元素的基态原子L层上有三个未成对电子,D元素为主族元素且与E元素同周期,其最外电子层上只有两个运动状态不同的电子,E元素有两种常见氧化物E2O、EO,其中E2O为砖红色.请回答: