题目内容
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,这四种元素原子的最外层电子数之和为20.
(1)试写出W元素基态原子核外电子排布式 .
(2)氢元素与Z形成原子个数比为1:1的化合物,其电子式为 .
(3)XZ2分子中含 个δ键, 个π键.
(4)恒温恒容下,2molH2与2molY的单质反应,达到平衡时,Y的单质为1.6mol,H2的转化率为 ;若该反应在恒温恒压条件下进行(其它条件相同),反应达到平衡时,H2的转化率比上述条件下的转化率 (填“大”、“小”或“相同”)
(5)下列说法正确的是
A.上述四种元素对应的单质中Z的单质最容易与H2化合
B.X、Y、Z原子半径依次减小
C.X、Y、Z第一电离能依次增大
D.Y的最高价氧化物对应水化物的酸性比W的强
(6)1892年比利时人索尔维采用将X的某种常见氧化物与Y的某种常见氢化物混合通入饱和食盐水中,最终制得了纯净的Na2CO3,该法又称为氨碱法.其第一步主要生成NaHCO3晶体,请写出该反应的化学方程式 .
| X | Y | Z |
| W |
(2)氢元素与Z形成原子个数比为1:1的化合物,其电子式为
(3)XZ2分子中含
(4)恒温恒容下,2molH2与2molY的单质反应,达到平衡时,Y的单质为1.6mol,H2的转化率为
(5)下列说法正确的是
A.上述四种元素对应的单质中Z的单质最容易与H2化合
B.X、Y、Z原子半径依次减小
C.X、Y、Z第一电离能依次增大
D.Y的最高价氧化物对应水化物的酸性比W的强
(6)1892年比利时人索尔维采用将X的某种常见氧化物与Y的某种常见氢化物混合通入饱和食盐水中,最终制得了纯净的Na2CO3,该法又称为氨碱法.其第一步主要生成NaHCO3晶体,请写出该反应的化学方程式
考点:位置结构性质的相互关系应用,元素电离能、电负性的含义及应用,共价键的形成及共价键的主要类型,化学平衡的计算
专题:元素周期律与元素周期表专题,化学键与晶体结构,化学平衡专题
分析:这几种元素都是短周期元素,根据元素在周期表中的位置知,X、Y、Z属于第二周期元素,W属于第三周期元素,设Y的最外层电子数是a,则X的最外层电子数是a-1,Z的最外层电子数是a+1,W的最外层电子数是a,这四种元素原子的最外层电子数之和为20,则a+a-1+a+1+a=20,a=5,则Y是第二周期第VA族元素,为N元素,则X是C元素、Z是O元素、W是P元素,结合元素、位置的结构和性质分析解答.
解答:
解:这几种元素都是短周期元素,根据元素在周期表中的位置知,X、Y、Z属于第二周期元素,W属于第三周期元素,设Y的最外层电子数是a,则X的最外层电子数是a-1,Z的最外层电子数是a+1,W的最外层电子数是a,这四种元素原子的最外层电子数之和为20,则a+a-1+a+1+a=20,a=5,则Y是第二周期第VA族元素,为N元素,则X是C元素、Z是O元素、W是P元素,
(1)W是P元素,其原子核外有15个电子,根据构造原理知,其原子核外电子排布式为:1S22S22P63S23P3,
故答案为:1S22S22P63S23P3;
(2)氢元素与Z形成原子个数比为1:1的化合物是双氧水,其化学式为H2O2,双氧水分子的电子式为: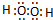 ,故答案为:
,故答案为: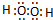 ;
;
(3)CO2分子的结构式为O=C=C,共价双键中含有一个δ键一个π键,所以二氧化碳分子中含有2个δ键、2个π键.
故答案为:2;2;
(4)一定条件下,氮气和氢气反应方程式为:N2+3H2?2NH3,达到平衡时,氮气反应的物质的量=(2-1.6)mol=0.4mol,根据氮气和氢气反应关系知,反应的氢气的物质的量是氮气的3倍,为1.2mol,则氢气的转化率=
×100%=60%,若该反应在恒温恒压条件下进行(其它条件相同),与恒温恒容相比,相当于增大压强,平衡向正反应方向移动,所以氢气的转化率增大,
故答案为:60%;大;
(5)A.元素的非金属性越强,越容易与氢气化合,上述四种元素中,非金属性最强的元素是N元素,所以对应的单质中Z的单质最容易与H2化合,故A正确;
B.同一周期中,元素的原子半径随着原子序数的增大而减小,所以X、Y、Z原子半径依次减小,故B正确;
C.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素大于相邻元素,故C错误;
D.Y的非金属性大于W,元素的非金属性越强,其对应的最高价氧化物的水化物酸性越强,所以Y的最高价氧化物对应水化物的酸性比W的强,故D正确;
故选ABD;
(6)Y的某种常见氢化物是氨气,氨气属于碱性气体,能和碳酸反应,则X的某种常见氧化物是二氧化碳,二氧化碳和氨气混合通入饱和食盐水中,第一步生成碳酸氢钠,根据元素守恒知,还生成氯化铵,反应方程式为:CO2+NH3+H2O+NaCl═NH4Cl+NaHCO3↓,
故答案为:CO2+NH3+H2O+NaCl═NH4Cl+NaHCO3↓.
(1)W是P元素,其原子核外有15个电子,根据构造原理知,其原子核外电子排布式为:1S22S22P63S23P3,
故答案为:1S22S22P63S23P3;
(2)氢元素与Z形成原子个数比为1:1的化合物是双氧水,其化学式为H2O2,双氧水分子的电子式为:
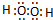 ,故答案为:
,故答案为: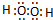 ;
;(3)CO2分子的结构式为O=C=C,共价双键中含有一个δ键一个π键,所以二氧化碳分子中含有2个δ键、2个π键.
故答案为:2;2;
(4)一定条件下,氮气和氢气反应方程式为:N2+3H2?2NH3,达到平衡时,氮气反应的物质的量=(2-1.6)mol=0.4mol,根据氮气和氢气反应关系知,反应的氢气的物质的量是氮气的3倍,为1.2mol,则氢气的转化率=
| 1.2mol |
| 2mol |
故答案为:60%;大;
(5)A.元素的非金属性越强,越容易与氢气化合,上述四种元素中,非金属性最强的元素是N元素,所以对应的单质中Z的单质最容易与H2化合,故A正确;
B.同一周期中,元素的原子半径随着原子序数的增大而减小,所以X、Y、Z原子半径依次减小,故B正确;
C.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素大于相邻元素,故C错误;
D.Y的非金属性大于W,元素的非金属性越强,其对应的最高价氧化物的水化物酸性越强,所以Y的最高价氧化物对应水化物的酸性比W的强,故D正确;
故选ABD;
(6)Y的某种常见氢化物是氨气,氨气属于碱性气体,能和碳酸反应,则X的某种常见氧化物是二氧化碳,二氧化碳和氨气混合通入饱和食盐水中,第一步生成碳酸氢钠,根据元素守恒知,还生成氯化铵,反应方程式为:CO2+NH3+H2O+NaCl═NH4Cl+NaHCO3↓,
故答案为:CO2+NH3+H2O+NaCl═NH4Cl+NaHCO3↓.
点评:本题考查了元素位置结构和性质相互关系,涉及氨碱法制取碳酸氢钠、化学平衡原理、核外电子排布式的书写等知识点,根据构造原理、化学平衡原理、元素周期律来分析解答即可,难度中等.

练习册系列答案
相关题目
用惰性电极电解一定浓度的CuSO4溶液,一段时间后停止电解,向所得的溶液中加入0.2mol Cu(OH)2后恰好恢复到电解前的原样,则电解过程中共转移的电子数是( )
| A、0.8 NA |
| B、0.6 NA |
| C、0.5 NA |
| D、0.4 NA |
下列说法正确的是( )
| A、1H、2H、3H互为同素异形体 |
| B、O2、O3互为同位素 |
| C、乙酸和甲酸甲酯互为同分异构体 |
| D、乙烷、乙烯、乙炔互为同系物 |
下列关于各实验装置的叙述正确的是( )


| A、装置①可用于收集C2H4、HCl、SO2等气体 |
| B、装置②可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
| C、装置③可用于吸收NH3、SO2、HCl等气体,并防止倒吸 |
| D、装置④可用于检查该装置的气密性 |
设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、摩尔是国际单位制中七个基本物理量之一 |
| B、标准状况下,22.4L水蒸气含有的分子数为NA |
| C、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| D、物质的量浓度为0.5mol?L-1的MgCl2溶液中,含有Cl-个数为NA |
