题目内容
下列根据实验操作和现象所得出的结论错误的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里 出现凝胶 | 酸性:盐酸>硅酸 |
| B | 向蛋白质溶液中滴加饱和CuSO4溶液 | 有固体析出 | 蛋白质发生变性 |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
| D | 向某溶液中先滴加KSCN溶液, 再滴加少量氯水 | 先无明显现象, 后溶液变成血红色 | 溶液中含有Fe2+,没有Fe3+ |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:
分析:A.试管里出现凝胶,说明生成硅酸;
B.蛋白质遇重金属盐发生变性;
C.常温下,铁与浓硫酸发生钝化反应;
D.先无明显现象,后溶液变成血红色,说明生成Fe3+.
B.蛋白质遇重金属盐发生变性;
C.常温下,铁与浓硫酸发生钝化反应;
D.先无明显现象,后溶液变成血红色,说明生成Fe3+.
解答:
解:A.试管里出现凝胶,说明生成硅酸,根据强酸制备弱酸的原理可知酸性:盐酸>硅酸,故A正确;
B.硫酸铜是重金属盐,蛋白质遇重金属盐发生变性,故B正确;
C.常温下,铁与浓硫酸发生钝化反应,而不是不反应,原因是在表面生成一层致密的氧化物膜而阻碍反应的进行,故C错误;
D.先无明显现象,后溶液变成血红色,说明溶液中含有Fe2+,没有Fe3+,氯水氧化Fe2+生成Fe3+,故D正确.
故选C.
B.硫酸铜是重金属盐,蛋白质遇重金属盐发生变性,故B正确;
C.常温下,铁与浓硫酸发生钝化反应,而不是不反应,原因是在表面生成一层致密的氧化物膜而阻碍反应的进行,故C错误;
D.先无明显现象,后溶液变成血红色,说明溶液中含有Fe2+,没有Fe3+,氯水氧化Fe2+生成Fe3+,故D正确.
故选C.
点评:本题考查化学实验方案的设计,涉及物质性质的考查,侧重点较为基础,题目难度不大.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
下列叙述正确的是( )
| A、浓度均为0.1mol?L-1的小苏打溶液与烧碱溶液等体积混合c(Na+)+c(H+)=2c(CO32-)+c(OH-) |
| B、某二元酸(H2A)在水中的电离方程式是:H2A=H++HA-,HA-?H++A2-;则NaHA溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A) |
| C、pH=12的氨水溶液与pH=2的盐酸溶液等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、常温下,10mLpH=12的Ba(OH)2溶液与40mLcmol?-1的NaHSO4溶液混合,当溶液中的Ba2+、SO42-均恰好完全沉淀,若混合后溶液的体积为50mL,则溶液pH=11 |
乙炔的空间构型是( )
| A、正四面体 | B、平面型 |
| C、直线型 | D、三角锥形 |
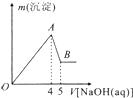 现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )
现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )| A、1:1 | B、3:2 |
| C、3:1 | D、6:1 |
某无色溶液中加入过量盐酸有沉淀产生,过滤后向滤液中加入过量氨水又有沉淀产生,下列溶液中符合条件的是( )
| A、Ag+、Al3+、Fe3+ |
| B、SiO32-、[Al(OH)4]-、K+ |
| C、Ag+、Cu2+、Na+ |
| D、Ag+、Ba2+、Na+ |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢或锂电池的十倍,可连续使用一个月才充一次电,其电池反应为:2CH3OH+3O2H-=2CO32-+6H2O,则下列有关说法不正确的是( )
| A、放电时化学能转变为电能 |
| B、放电时CH3OH参与正极反应 |
| C、充电时阴极产CH3OH |
| D、充电时每生成1molCH3OH,则转移6mol电子 |
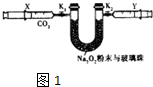 (1)如图1注射器X中抽取100mL CO2,U形管中装有适量小玻璃珠和约1.5gNa2O2粉末,打开K1、K2止水夹,缓缓将CO2压至U形管中,观察到的实验现象是
(1)如图1注射器X中抽取100mL CO2,U形管中装有适量小玻璃珠和约1.5gNa2O2粉末,打开K1、K2止水夹,缓缓将CO2压至U形管中,观察到的实验现象是