题目内容
下列实验能获得成功的是( )
| 实验目的 | 实验步骤及现象 | |
| A | 除去苯中的苯酚 | 加入浓溴水,充分振荡、静置,然后过滤 |
| B | 证明醋酸的酸性比次氯酸强 | 用pH试纸分别测定常温下等浓度的醋酸和次氯酸的pH值,pH大的是次氯酸 |
| C | 检验Na2SO3固体中含Na2SO4 | 试样加水溶解后,加入足量盐酸,再加入BaCl2溶液,有白色沉淀 |
| D | 检验溴乙烷中含有溴元素 | 溴乙烷与氢氧化钠溶液混合振荡后,再向混合液中滴加硝酸银溶液,有淡黄色沉淀 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.溴以及三溴苯酚都溶于苯中;
B.次氯酸具有漂白性;
C.加入盐酸,可排除Na2SO3的影响;
D.检验溴离子,应先调节溶液至酸性.
B.次氯酸具有漂白性;
C.加入盐酸,可排除Na2SO3的影响;
D.检验溴离子,应先调节溶液至酸性.
解答:
解:A.苯酚与溴发生取代反应生成三溴苯酚,溴以及三溴苯酚都溶于苯中,应用氢氧化钠溶液除杂,故A错误;
B.次氯酸具有漂白性,可使pH试纸先变红后褪色,故B错误;
C.加入盐酸,可排除Na2SO3的影响,再加入BaCl2溶液,可生成硫酸钡白色沉淀,可用于检验,故C正确;
D.反应在碱性条件下水解,检验溴离子,应先调节溶液至酸性,故D错误.
故选C.
B.次氯酸具有漂白性,可使pH试纸先变红后褪色,故B错误;
C.加入盐酸,可排除Na2SO3的影响,再加入BaCl2溶液,可生成硫酸钡白色沉淀,可用于检验,故C正确;
D.反应在碱性条件下水解,检验溴离子,应先调节溶液至酸性,故D错误.
故选C.
点评:本题考查较为综合,涉及物质的鉴别、分离和提纯,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,难度不大,注意把握物质的性质的异同.

练习册系列答案
 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
 如图是利用试纸、铅笔芯设计的微型实验.以铅笔芯为电极,分别接触表面皿上的试纸,接通电源,观察实验现象.下列说法错误的是( )
如图是利用试纸、铅笔芯设计的微型实验.以铅笔芯为电极,分别接触表面皿上的试纸,接通电源,观察实验现象.下列说法错误的是( )| A、pH试纸变蓝 |
| B、KI-淀粉试纸变蓝 |
| C、通电时,电能转换为化学能 |
| D、电子通过pH试纸到达KI-淀粉试纸 |
下列说法正确的是( )
| A、配制100mL 1.0mol/L CuSO4溶液,可将25g CuSO4?5H20溶于100mL蒸馏水中 |
| B、将几根火柴头浸于水中,一段时间后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
| C、用纸上层析法分离某些物质时,为了看到色斑,只有有色离子的物质才可以用纸层析法 |
| D、减压过滤时,吸滤瓶内液面高度将达到支管口时,应拔掉吸滤瓶上的橡皮管,并从吸滤瓶支管口倒出溶液 |
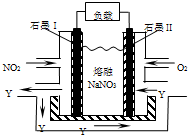 NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,该电池在使用过程中石墨I电极上生成氧化物Y,下列说法不正确的是( )
NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,该电池在使用过程中石墨I电极上生成氧化物Y,下列说法不正确的是( )| A、石墨I附近发生的反应为NO2+NO3--e-═N2O5 |
| B、石墨Ⅱ附近反生的反应为O2-4e-═2O2- |
| C、该电池放电时NO3-从右侧向左侧迁移 |
| D、相同条件下,放电过程中消耗的NO2和O2的体积比为4:1 |
下列说法不正确的是( )
| A、太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 |
| B、常用的自来水消毒剂有氯气和二氧化氯,两者都含有极性键 |
| C、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| D、在车排气管上加装“催化转化器”是为了减少有害气体的排放 |
化学与科学、技术、社会、环境密切相关.下列有关说法中正确的是( )
| A、明矾[KAl(SO4)2?12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| B、变质的植物油有难闻的特殊气味,是由于植物油发生了酯化反应 |
| C、浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 |
| D、海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化 |
下列反应属于氧化还原反应的是:( )
A、CaCO3
| ||||
| B、CaCO3+2HCl═CaCl2+H2O+CO2↑ | ||||
C、CuO+CO
| ||||
| D、CuO+H2SO4═CuSO4+H2O |
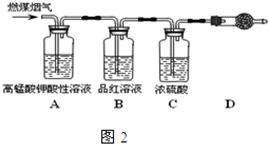
 (4)在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇CO(g)+2H2(g)═CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
(4)在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇CO(g)+2H2(g)═CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则: