题目内容
5.利用辉铜矿冶铜时发生的主要反映为Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2,下列有关该反应的说法中正确的是( )| A. | 硫元素被氧化 | B. | O2失去电子 | ||
| C. | CuS仅作还原剂 | D. | 反应中Cu元素化合价没有发生变化 |
分析 A.化合价升高的元素失去电子被氧化;
B.化合价降低的元素得到电子;
C.还原剂是元素化合价升高的物质;氧化剂是元素化合价降低的物质;
D.Cu2S 在反应中,铜元素化合价从+1价变化降低为0价.
解答 解:A.在该反应中S元素的化合价由反应前Cu2S中的-2价变为反应后SO2中的+4价,化合价升高,失去电子,硫元素被氧化,故A正确;
B.O2中氧元素的化合价由反应前O2的0价变为反应后SO2的-2价,化合价降低,得到电子,故B错误;
C.Cu2S 在反应中,铜元素化合价从+1价变化降低为0价,硫元素化合价从-2价升高到+4价;所以Cu2S 在反应中做氧化剂和还原剂,故C错误;
D.Cu2S 在反应中,铜元素化合价从+1价变化降低为0价,则Cu元素化合价降低,获得电子,被还原,故D错误;
故选A.
点评 本题考查了氧化还原反应的概念分析判断,关键是判断反应前后元素化合价变化,题目难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
15.对 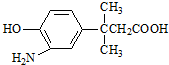 的表述不正确的是( )
的表述不正确的是( )
 的表述不正确的是( )
的表述不正确的是( )| A. | 该物质能发生缩聚反应 | |
| B. | 该物质的核磁共振氢谱上共有7个峰 | |
| C. | 该物质遇FeCl3溶液显色 | |
| D. | 1 mol该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为2:2:1 |
16.关于反应Zn+2HNO3+NH4NO3═N2↑+3H2O+Zn(NO3)2,下列判断正确的是( )
| A. | 生成1 mol N2,电子转移总数为3NA | B. | 生成1 mol N2,电子转移总数为5NA | ||
| C. | 溶解1 mol Zn,电子转移总数为2NA | D. | 溶解1 mol Zn,电子转移总数为4NA |
20.下列变化属于物理变化的是( )
| A. | 煤的干馏 | B. | 石油的分馏 | C. | 铁器生锈 | D. | 红磷转化为白磷 |
10.下列对分子中δ键重叠方式的分析不正确的是( )
| A | B | C | D |
| H2 | HCl | Cl2 | ClF |
| 两个原子的s轨道重叠 | 氢原子的s轨道和氯原子的p轨道重叠 | 一个氯原子的s轨道和另一个氯原子的p轨道重叠 | 氯原子的p轨道和氟原子的p轨道重叠 |
| A. | A | B. | B | C. | C | D. | D |
17.有机物( )有多种同分异构体,其中能与NaHCO3溶液反应且属于芳香族化合物的共有( )
)有多种同分异构体,其中能与NaHCO3溶液反应且属于芳香族化合物的共有( )
 )有多种同分异构体,其中能与NaHCO3溶液反应且属于芳香族化合物的共有( )
)有多种同分异构体,其中能与NaHCO3溶液反应且属于芳香族化合物的共有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
14.在氢氧化钠溶液中加入一定量的稀盐酸后,下列实验能证明两者恰好完全中和的是( )
| A. | 滴入适量AgNO3溶液和稀硝酸,观察到有白色沉淀 | |
| B. | 滴入适量FeCl3溶液,溶液变黄,但无沉淀生成 | |
| C. | 测得反应后溶液中Na+与Cl-的个数比为1:1 | |
| D. | 滴入几滴酚酞试液,酚酞试液不变色 |
15.下列措施对增大化学反应速率明显有效的是( )
| A. | Na与水反应时增大水的用量 | |
| B. | Fe与稀硫酸反应制取氢气时,改用浓硫酸 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| D. | 将铝片改为铝粉,做铝与氧气反应的实验 |
