题目内容
11.在反应容器中充入1molA气体和n molB气体,在一定条件下发生反应:A(气)+nB(气)?mC(气),达平衡时,测得A的转化率为50%,在相同温度和相同压强下,平衡时混合气体的体积是反应前的$\frac{3}{4}$,则n和m的数值可能是( )| A. | n=1 m=1 | B. | n=2 m=2 | C. | n=3 m=3 | D. | n=2 m=3 |
分析 达平衡时,测得A的转化率为50%,则转化的A为1mol×50%=0.5mol,则
A(气)+nB(气)?mC(气)
开始 1 n 0
转化 0.5 0.5n 0.5m
平衡 0.5 0.5n 0.5m
平衡时混合气体的体积是反应前的$\frac{3}{4}$,则
$\frac{0.5+0.5n+0.5m}{1+n}$=$\frac{3}{4}$,以此来解答.
解答 解:达平衡时,测得A的转化率为50%,则转化的A为1mol×50%=0.5mol,则
A(气)+nB(气)?mC(气)
开始 1 n 0
转化 0.5 0.5n 0.5m
平衡 0.5 0.5n 0.5m
平衡时混合气体的体积是反应前的$\frac{3}{4}$,则
$\frac{0.5+0.5n+0.5m}{1+n}$=$\frac{3}{4}$,
解得n+1=2m,
A.n=1、m=1,符合n+1=2m,故A选;
B.n=2、m=2,n+1<2m,故B不选;
C.n=3、m=3,n+1<2m,故C不选;
D.n=2、m=3,n+1<2m,故D不选;
故选A.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、物质的量与压强的关系为解答的关键,侧重分析与计算能力的考查,注意n与m的关系,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
1.下列事实不能用勒夏特列原理解释的是( )
| A. | 向饱和的胆矾溶液中加入一些无水硫酸铜粉末,很快有较多量的蓝色晶体形成 | |
| B. | 钢铁在潮湿的空气中容易生锈 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
2.下列对胶体的认识不正确的是( )
| A. | 光线透过胶体时,可产生丁达尔效应 | |
| B. | 胶体区别于其他分散系的本质特征是产生丁达尔效应 | |
| C. | 胶体在一定的条件下也能稳定存在,属介稳体系 | |
| D. | Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水的目的 |
19.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,有关叙述正确的是( )
| A. | 氯化硼液态时能导电而固态时不导电 | |
| B. | 氯化硼分子空间上是三角锥形 | |
| C. | 氯化硼熔点低是因为硼氯键键能较小 | |
| D. | 氯化硼属非极性分子 |
6.Mg(OH)2可用作塑料的阻燃剂.现以某矿石(主要成分为3MgO•2SiO2•2H2O,还有少量Fe2O3、FeO、CaO和Al2O3)为原料生产,其工艺流程如下:
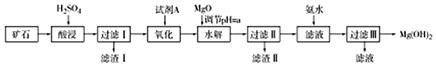
已知:
表1生成氢氧化物沉淀的pH
表2原料价格表
回答下列问题:
(1)酸浸时,为提高矿石的浸出率可采取的措施为将矿石粉碎(任写一条).该过程H2SO4适当过量的目的是使固体充分溶解、使Ca2+以CaSO4沉淀形式除去.
(2)工业生产要求生产成本较低,产品尽量不含杂质.试剂A的最佳选择是漂液(或NaClO),写出其发生反应的离子方程式2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)水解过程需调节溶液pH,a的取值范围为4.7≤a<9.1,滤渣II的成分是Fe(OH)3、Al(OH)3(填化学式).
(4)向过滤II所得滤液中加入一定量氨水,写出镁离子沉淀的离子方程式Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+,该过程温度不宜过高的原因是氨水受热分解.
(5)实际生产中,可由Mg(OH)2为原料制备单质镁,简述制备方法Mg(OH)2与盐酸反应生产MgCl2,蒸发浓缩冷却结晶得到MgCl2•6H2O晶体,在HCl气流中加热失水得到无水MgCl2,电解熔融的MgCl2制取金属Mg.

已知:
表1生成氢氧化物沉淀的pH
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 7.6 | 1.9 | 3.4 | 9.1 |
| 完全沉淀的pH | 9.6 | 3.2 | 4.7 | 11.1 |
| 物质 | 价格(元•吨-1) |
| 漂液(含25.2% NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
(1)酸浸时,为提高矿石的浸出率可采取的措施为将矿石粉碎(任写一条).该过程H2SO4适当过量的目的是使固体充分溶解、使Ca2+以CaSO4沉淀形式除去.
(2)工业生产要求生产成本较低,产品尽量不含杂质.试剂A的最佳选择是漂液(或NaClO),写出其发生反应的离子方程式2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)水解过程需调节溶液pH,a的取值范围为4.7≤a<9.1,滤渣II的成分是Fe(OH)3、Al(OH)3(填化学式).
(4)向过滤II所得滤液中加入一定量氨水,写出镁离子沉淀的离子方程式Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+,该过程温度不宜过高的原因是氨水受热分解.
(5)实际生产中,可由Mg(OH)2为原料制备单质镁,简述制备方法Mg(OH)2与盐酸反应生产MgCl2,蒸发浓缩冷却结晶得到MgCl2•6H2O晶体,在HCl气流中加热失水得到无水MgCl2,电解熔融的MgCl2制取金属Mg.
4.n克的H2SO4所含氧原子的物质的量是( )
| A. | $\frac{n}{98}$moL | B. | $\frac{7n}{98}$moL | C. | $\frac{4n}{98}$moL | D. | $\frac{4n}{32}$moL |
1.多原子分子氰[(CN)2]、硫氰[(SCN)2]和(OCN)2的性质与卤素单质相似,故称它们为类卤素,它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I).
(1)在表中①、②、③的空格处应填写的名称或化学式分别是氧氰、HSCN、KOCN.
(2)完成下列反应的化学方程式或离子方程式.
①(CN)2和KOH溶液反应的化学方程式为(CN)2+2KOH═KCN+KCNO+H2O.
②已知阴离子的还原性:Cl-<Br-<CN-<SCN-<I-.试写出在NaBr和KSCN的混合溶液中加入(CN)2时发生反应的离子方程式:(CN)2+2SCN-═2CN-+(SCN)2.
| 卤素 | 氰 | 硫氰 | ① | |
| “单质” | X2 | (CN)2 | (SCN)2 | (OCN)2 |
| 酸 | HX | HCN | ② | HOCN |
| 盐 | KX | KCN | KSCN | ③ |
(2)完成下列反应的化学方程式或离子方程式.
①(CN)2和KOH溶液反应的化学方程式为(CN)2+2KOH═KCN+KCNO+H2O.
②已知阴离子的还原性:Cl-<Br-<CN-<SCN-<I-.试写出在NaBr和KSCN的混合溶液中加入(CN)2时发生反应的离子方程式:(CN)2+2SCN-═2CN-+(SCN)2.
2.在下列溶液中分别通入足量的CO2,最终产生沉淀的是( )
| A. | 氯化钙 | B. | 氢氧化钙 | C. | 氯化钠 | D. | 偏铝酸钠 |