题目内容
下列叙述中不正确的是( )
| A、钠在空气中燃烧后发出黄色的火焰 |
| B、Na2O2是淡黃色固体,是强氧化剂,可用来漂白织物等 |
| C、氧化剂在化学反应中得到电子,所含元素化合价都降低 |
| D、离子方程式的书写时弱电解质、单质等写成化学式 |
考点:钠的化学性质,重要的氧化剂,钠的重要化合物
专题:元素及其化合物
分析:A.Na的焰色反应为黄色;
B.Na2O2是淡黃色固体,为常见的氧化剂;
C.氧化剂中某元素的化合价降低;
D.单质、弱电解质在离子反应中保留化学式.
B.Na2O2是淡黃色固体,为常见的氧化剂;
C.氧化剂中某元素的化合价降低;
D.单质、弱电解质在离子反应中保留化学式.
解答:
解:A.Na的焰色反应为黄色,则钠在空气中燃烧后发出黄色的火焰,故A正确;
B.Na2O2是淡黃色固体,为常见的氧化剂,具有强氧化剂,可用来漂白织物等,故B正确;
C.氧化剂中某元素的化合价降低,得到电子被还原,如过氧化钠与水反应,只有过氧化钠中O元素的化合价变化,而Na元素的化合价不变,故C错误;
D.单质、弱电解质等在离子反应中保留化学式,以此可书写离子反应方程式,故D正确;
故选C.
B.Na2O2是淡黃色固体,为常见的氧化剂,具有强氧化剂,可用来漂白织物等,故B正确;
C.氧化剂中某元素的化合价降低,得到电子被还原,如过氧化钠与水反应,只有过氧化钠中O元素的化合价变化,而Na元素的化合价不变,故C错误;
D.单质、弱电解质等在离子反应中保留化学式,以此可书写离子反应方程式,故D正确;
故选C.
点评:本题考查物质的化学性质及相互转化,为高频考点,把握物质的性质及发生的化学反应为解答的关键,侧重分析与知识应用能力的考查,题目难度不大.

练习册系列答案
相关题目
下列实验操作正确的是( )
| A、用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
| B、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
| C、先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称 |
| D、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
明矾可以达到净化水质的作用,除了明矾外,还可用下列中的物质达到净水的目的( )
| A、活性炭 | B、高锰酸钾 |
| C、二氧化碳 | D、澄清石灰水 |
某老师阅学生实验报告,发现几位学生记录着下列内容,由此推断学生以科学的态度做了实验的是( )
| A、甲学生配NaOH溶液,用电子天平称取固体1.2 g |
| B、乙学生用广泛pH试纸测定溶液的酸碱性:pH=14.5 |
| C、丙学生用50mL量筒量取46.70mL浓盐酸 |
| D、丁学生用红柄滴定管量取25.00mL0.1mol/L的盐酸 |
某温度下对于反应2NO2(g)?N2O4(g);△H<0,在一定密闭容器中达到平衡,下列说法错误的是( )
| A、加压时(容器体积减小),正反速率增大 |
| B、保持压强不变,加入N2,正反速率变小 |
| C、保持压强不变,加入少许N2O4,再达到平衡,颜色变深 |
| D、保持体积不变,升高温度,再达到平衡时,颜色变深 |
 美丽的“水立方”(Water Cube)是北京奥运会游泳馆,设计灵感来自于有机细胞的天然图案以及肥皂泡的形成.在这个中心的蓝色汽泡墙之内,钢结构的基本单位是一个由 12 个正五边形和2个正六边形所组成的几何细胞.覆盖这个框架的是半透明的汽泡,称为PTFE膜(聚四氟乙烯),它能为场馆内带来更多的自然光.根据以上信息,下列说法不正确的是( )
美丽的“水立方”(Water Cube)是北京奥运会游泳馆,设计灵感来自于有机细胞的天然图案以及肥皂泡的形成.在这个中心的蓝色汽泡墙之内,钢结构的基本单位是一个由 12 个正五边形和2个正六边形所组成的几何细胞.覆盖这个框架的是半透明的汽泡,称为PTFE膜(聚四氟乙烯),它能为场馆内带来更多的自然光.根据以上信息,下列说法不正确的是( )| A、若设想将一个结构单元钢棍焊成足球形状“碳笼”,它与C24形状相似 |
| B、若设想将一个结构单元钢棍焊成足球形状“碳笼”,需钢棍(相当于键)36 根 |
| C、PTFE的单体为:CF2=CF2 |
| D、PTFE在空气中易被氧气氧化 |
下列叙述错误的是( )
| A、纤维素的水解实验操作为:把一小团棉花放入试管中,加入几滴90%的硫酸溶液,用玻璃棒把棉花捣成糊状,小火微热,至成亮棕色溶液 |
| B、向油脂发生皂化反应后所得的混合溶液中加入固体NaCl会出现分层现象,此分层过程发生的主要是物理变化 |
| C、只用滴管、试管和水就能鉴别乙二醇、溴代烃、乙醛 |
| D、已知苯与苯酚的沸点差异较大,故一定能用蒸馏的方法分离苯与苯酚的混合液 |
下列各组物质中,互称为同分异构体的是( )
| A、1H 和2H |
| B、O2与O3 |
C、 与 与 |
D、 与 与 |
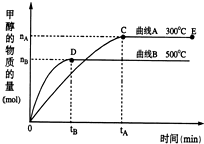 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)