题目内容
20.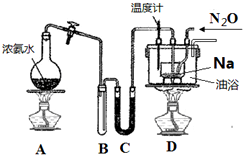 叠氮化钠 (NaN3) 常作为汽车安全气囊的药剂,其固体易溶于水,微溶于乙醇,不溶于乙醚.
叠氮化钠 (NaN3) 常作为汽车安全气囊的药剂,其固体易溶于水,微溶于乙醇,不溶于乙醚.(1)实验室制取叠氮化钠的原理、装置及主要步骤如下.
ⅰ.2Na+NH3 $\frac{\underline{\;\;△\;\;}}{\;}$2NaNH2+H2ⅱ.
NaNH2+N2O $\frac{\underline{\;210-220℃\;}}{\;}$NaN3+H2O,
①组装仪器检查装置气密性后,装入药品.装置C中盛放的药品是碱石灰.
②实验过程应先点燃A(填“A”或“D”)的酒精灯,理由是先产生NH3,将装置内空气驱赶除去,防止产品不纯.
③在反应ⅰ充分进行后,通入N2O气体,加热.此时采用油浴而不用水浴的主要原因是水浴温度达不到反应所需的温度210℃-220℃.
(2)装置D反应完全结束后,取出混合物进行以下操作,得到NaN3固体:
D中混合物$→_{Ⅰ}^{加水}$$→_{Ⅱ}^{加乙醇}$$→_{Ⅲ}^{过滤}$$→_{Ⅳ}^{洗涤}$$→_{Ⅴ}^{干燥}$NaN3
已知:NaNH2能与水反应生成NaOH和氨气.
操作ⅱ的目的是降低NaN3的溶解量或溶解度或促使NaN3析出;操作ⅳ最好选用的试剂是乙醚.
(3)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数.测定过程反应方程式为
2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑.Ce4++Fe2+=Ce3++Fe3+
首先将2.50g试样配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入50.00mL 0.1000mol•L-1(NH4)2Ce(NO3)6,充分反应后,将溶液稍稀释,向溶液中加入5mL浓硫酸,滴入2滴邻菲哕啉指示液,用0.0500mol•L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为24.00mL.
①则试样中含NaN3的质量分数为98.8%.
②为了提高该实验的精确度,该实验需要补充平行实验.
(4)消防时,销毁NaN3常用NaClO溶液,该反应过程中只有N2一种气体生成,写出反应方程式2NaN3+NaClO+H2O=NaCl+3N2↑+2NaOH.
分析 (1)①氨气选择碱石灰干燥;
②先点燃A产生氨气将装置内空气驱赶除去,防止产品不纯;
③从反应温度来选择加热方式;
(2)根据叠氮化钠 (NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,可知乙醇可降低NaN3的溶解度促使NaN3析出,乙醚洗涤叠氮化钠可减少叠氮化钠的损失;
(3)①计算n[(NH4)2Ce(NO3)6],n[(NH4)2Fe(SO4)2],结合滴定过程,叠氮化钠和六硝酸铈铵反应,剩余的六硝酸铈铵,加入浓硫酸,用0.0500mol•L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+,结合化学方程式定量关系计算;
②为了提高该实验的精确度,氧化还原反应滴定实验一般要用平行实验,求平均值;
(4)根据氮元素化合价升高,氯元素化合价降低写出方程式.
解答 解:(1)①A中产生的氨气混有水蒸气,干燥氨气选择碱石灰,则在C中盛放的药品是碱石灰,
故答案为:碱石灰;
②实验过程中先点燃A产生氨气将装置内空气驱赶除去,防止产品不纯,
故答案为:A;先产生NH3,将装置内空气驱赶除去,防止产品不纯;
③NaNH2+N2O $\frac{\underline{\;210℃-220℃\;}}{\;}$NaN3+H2O,水浴温度达不到反应所需的温度210℃-220℃,
故答案为:水浴温度达不到反应所需的温度210℃-220℃;
(2)D中混合物加水后,根据叠氮化钠 (NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,NaN3溶解在水中,NaNH2与水反应生成NaOH和氨气,可知操作Ⅱ加乙醇可降低NaN3的溶解度促使NaN3析出;乙醚洗涤叠氮化钠可减少叠氮化钠的损失,
故答案为:降低NaN3的溶解量或溶解度或促使NaN3析出;乙醚;
(3)①计算n[(NH4)2Ce(NO3)6],n[(NH4)2Fe(SO4)2],结合滴定过程,叠氮化钠和六硝酸铈铵反应,剩余的六硝酸铈铵,加入浓硫酸,用0.0500mol•L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+,结合化学方程式定量关系计算:
n[(NH4)2Ce(NO3)6]=0.1000mol•L-1×50.00×10-3L=5.000×10-3mol,
n[(NH4)2Fe(SO4)2]=0.0500mol•L-1×24.00×10-3L=1.200×10-3mol,
与NaN3反应的n[(NH4)2Ce(NO3)6]=5.000×10-3mol-1.200×10-3mol=3.800×10-3mol,
ω=$\frac{3.800×1{0}^{-3}mol×65g/mol}{2.50g×\frac{25.00mL}{250mL}}$×100%=98.8%,
故答案为:98.8%;
②为了提高该实验的精确度,氧化还原反应滴定实验一般要用平行实验,求平均值,
故答案为:平行实验;
(4)根据氮元素化合价高,氯元素化合价降低且只有N2一种气体生成,则氯只能从+1降到-1价,其他元素化合价不变,水参加反应,生成氯化钠、氮气、氢氧化钠,
则反应方程式为:2NaN3+NaClO+H2O=NaCl+3N2↑+2NaOH,
故答案为:2NaN3+NaClO+H2O=NaCl+3N2↑+2NaOH.
点评 本题考查了物质组成的实验探究和定量测定方法,过程分析判断,主要是试剂反应过程的理解应用,掌握基础是关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 能大量存在:Na+、C6H5O-、Cl-、Br- | |
| B. | 同温下通入少量的氨气:NH4+的水解能力增强,Kw增大,有白色沉淀产生 | |
| C. | 加入Ba(OH)2溶液生成沉淀质量最多的离子方程式:NH4++Al3++2Ba2++5OH-+2SO42-=2BaSO4↓+AlO2-+NH3•H2O+2H2O | |
| D. | 其浓溶液可与NaHCO3溶液混合制成灭火器 |
| A. | 升高温度,该反应的平衡常数将增大 | |
| B. | 从平衡混合气中分离出水蒸气可提高CO2和H2的利用率 | |
| C. | 再向该容器中充入2 mol H2和1 mol CO2,达到平衡时,H2的转化率将小于CO2 | |
| D. | T℃,在起始体积为V L的密闭容器(容积可变,恒压)中将3 mol H2和1 mol CO2混合,达到平衡时乙醇体积分数大于a |
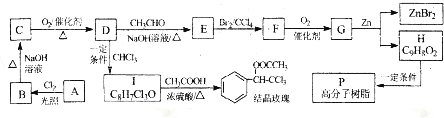
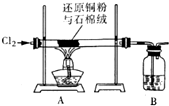 氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成的催化剂.
氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成的催化剂.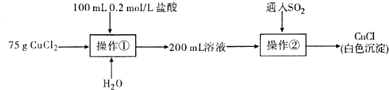
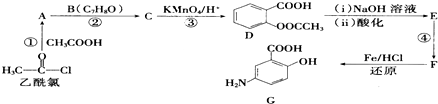
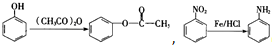 ,(具有还原性,极易被氧化)
,(具有还原性,极易被氧化) .
. .
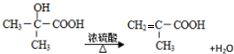
.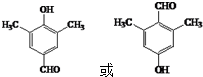 (写出其中一种结构简式).
(写出其中一种结构简式).
 $\stackrel{HCN}{→}$
$\stackrel{HCN}{→}$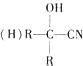 $→_{H+}^{H_{2}O}$
$→_{H+}^{H_{2}O}$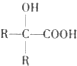
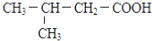 B.
B.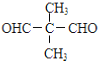 C.
C.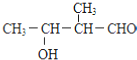 D.
D.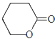
 .
. )可以生物降解,实现在自然界中的循环,是理想的绿色高分 子材料.请以乙醛为有机原料,设计聚乳酸的合成路线.(无机试剂任选,合成路线参照“已 知”中的书写形式)
)可以生物降解,实现在自然界中的循环,是理想的绿色高分 子材料.请以乙醛为有机原料,设计聚乳酸的合成路线.(无机试剂任选,合成路线参照“已 知”中的书写形式) .
.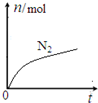 某离子反应中涉及到H、O、Cl、N四种元素形成的六种微粒,N2、H2O、ClO-、H+、NH4+、Cl-,其中N2的物质的量随时间变化的曲线如图所示:
某离子反应中涉及到H、O、Cl、N四种元素形成的六种微粒,N2、H2O、ClO-、H+、NH4+、Cl-,其中N2的物质的量随时间变化的曲线如图所示: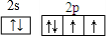 ,该化学用语不能表达出氧原子最外层电子的c(填序号).
,该化学用语不能表达出氧原子最外层电子的c(填序号).
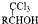
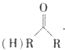
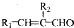 (R、R1、R2代表烃基或氢原子)
(R、R1、R2代表烃基或氢原子)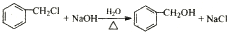 ;
;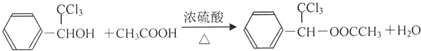 ;
;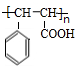 ;
;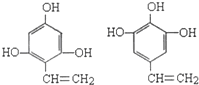 .
.