题目内容
8.将64g铜与200mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为22.4L.请回答:(1)NO的体积为11.2L,NO2的体积为11.2L.
(2)待产生的气体全部释放后,向溶液中加入VmL a mol•L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为$\frac{aV×1{0}^{-3}+1}{0.2}$mol•L-1.(用含a、V的式子表示)
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要往其中加入25%的双氧水68g.
(已知:2NO2+2NaOH═NaNO2+NaNO3+H2O;NO+NO2+2NaOH═2NaNO2+H2O)
分析 (1)根据n=$\frac{n}{m}$计算铜的物质的量,根据n=$\frac{V}{{V}_{m}}$计算混合气体的物质的量,令混合气体中NO和NO2物质的量分别为xmol、ymol,利用电子转移守恒、二者物质的量之和列方程,据此计算x、y的值,再根据v=nVm计算NO、NO2的体积;
(2)向反应后溶液中加入NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,由钠离子守恒n(NaNO3)=n(NaOH),根据氮原子守恒可知n(HNO3)=n(NaNO3)+n(NO2+NO),再根据c=$\frac{n}{V}$计算;
(3)一氧化氮和二氧化氮变成硝酸钠需要失去电子总数等于铜与硝酸反应时失去电子数,也等于过氧化氢得到的电子数,以此计算需要双氧水的质量.
解答 解:(1)64g铜的物质的量为$\frac{64g}{64g/mol}$=1mol,22.4L混合气体的物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,
令混合气体中NO和NO2物质的量分别为xmol、ymol,
由电子转移守恒有:3x+y=1×2,
由二者物质的量之和:x+y=1,
联立方程,解得x=0.5,y=0.5,
故NO的体积为0.5mol×22.4L/mol=11.2L,
NO2的体积为0.5mol×22.4L/mol=11.2L,
故答案为:11.2;11.2;
(2)向反应后溶液中加入NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,由钠离子守恒n(NaNO3)=n(NaOH)=aV×10-3mol,根据氮原子守恒可知n(HNO3)=n(NaNO3)+n(NO2+NO)=aV×10-3mol+1mol,所以c=$\frac{n}{V}$=$\frac{aV×1{0}^{-3}+1}{0.2}$mol/L,故答案为:$\frac{aV×1{0}^{-3}+1}{0.2}$;
(3)设需过氧化氢xmol,由电子守恒可知1mol×2=xmol×2×(2-1),解得x=0.5mol,其质量为0.5mol×34g/mol=17g,则需要25%的双氧水为$\frac{17g}{25%}$=68g,
故答案为:68.
点评 本题考查化学反应方程式的计算,明确铜与硝酸反应中的原子守恒及电子守恒是解答本题的关键,注意体会守恒法在计算中的重要应用,题目难度中等.

| A. | 小苏打的主要成分是碳酸钠 | |
| B. | NaHCO3的热稳定性小于Na2CO3 | |
| C. | KCl和Na2CO3的固体混合物,加水溶解时有沉淀生成,且沉淀溶于稀盐酸 | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀,其离子方程式可以表示为:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+H2O |
| A. | 离子化合物中一定不含共价键 | |
| B. | 共价化合物中一定不含离子键 | |
| C. | 全部由非金属元素形成的化合物一定是共价化合物 | |
| D. | 金属元素和非金属元素之间形成的化学键一定是离子键 |
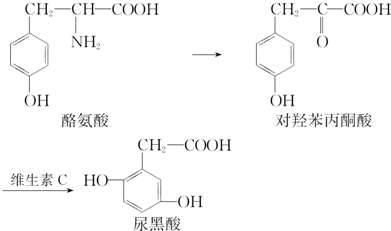
| A. | 酪氨酸既能与盐酸反应又能与NaOH溶液反应 | |
| B. | 对羟苯丙酮酸分子中有2种含氧官能团 | |
| C. | 1 mol尿黑酸最多可与含1 mol NaOH的溶液反应 | |
| D. | 可用溴水鉴别对羟苯丙酮酸与尿黑酸 |
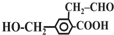 ,它在一定条件下可能发生的反应有 ①加成 ②水解 ③酯化 ④银镜反应 ⑤中和 ⑥消去 ⑦缩聚 其中正确的是( )
,它在一定条件下可能发生的反应有 ①加成 ②水解 ③酯化 ④银镜反应 ⑤中和 ⑥消去 ⑦缩聚 其中正确的是( )| A. | ②③④⑦ | B. | ①③⑤⑥ | C. | ①③④⑤⑦ | D. | ①③④⑤⑥ |
 全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟.如图是钒电池基本工作原理示意图:
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟.如图是钒电池基本工作原理示意图: 大型飞机的发动机被誉为航空工业皇冠上的“宝石”.制造过程中通常采用碳化钨做关键部位的材料
大型飞机的发动机被誉为航空工业皇冠上的“宝石”.制造过程中通常采用碳化钨做关键部位的材料